
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Elektronegatiwiteit verwys na die vermoë van 'n atoom om gedeelde elektrone in 'n kovalente binding aan te trek. Hoe hoër die waarde van die elektronegatiwiteit , die meer sterk dit element trek die gedeelde elektrone aan. Fluoor is dus die mees elektronegatiewe element , terwyl francium een van die minste is elektronegatief.
Hierin, wat maak iets meer elektronegatief?
Elektronegatiwiteit is 'n maatstaf van 'n atoom se vermoë om die gedeelde elektrone van 'n kovalente binding na homself aan te trek. As die twee atome van die binding gelyk is elektronegatiwiteit , word die elektrone gelykop gedeel. As een atoom is meer elektronegatief , die elektrone van die binding is meer aangetrokke tot daardie atoom.
Verder, wat maak dat 'n atoom 'n hoë elektronegatiwiteit het? Verduideliking: Die elektronegatiwiteit waarde is hoog wanneer die afskermingseffek wat deur die betrokke elektron ervaar word laag is en die valensieskil van die atoom is óf vol óf amper vol. Dit lei tot die He-kern met 'n hoër beheer van sy valenselektron as sesium oor sy valenselektron.
As u dit in die oog hou, wat bepaal die elektronegatiwiteit van 'n element?
Elektronegatiwiteit , simbool χ, is 'n chemiese eienskap wat die neiging van 'n beskryf atoom om 'n gedeelde paar elektrone (of elektrondigtheid) na homself te lok. An atoom se elektronegatiwiteit word beïnvloed deur beide sy atoomgetal en die afstand waarteen sy valenselektrone van die gelaaide kern woon.
Hoe neem elektronegatiwiteit toe op die periodieke tabel?
Die positief gelaaide protone in die kern trek die negatief gelaaide elektrone aan. As die aantal protone in die kern verhogings , die elektronegatiwiteit of aantrekkingskrag sal Verhoog . Daarom elektronegatiwiteit neem toe van links na regs in 'n ry in die periodieke tabel.
Aanbeveel:
Wat is die kleinste deeltjie van 'n element wat die eienskappe van die element behou?

'n Atoom is die kleinste deeltjie van enige element wat steeds die eienskappe van daardie element behou. 'n Stuk van 'n element wat ons kan sien of hanteer, bestaan uit baie, baie atome en alle atome is dieselfde hulle het almal dieselfde aantal protone
Wat is 'n uitdrukking wat een of meer veranderlikes bevat?
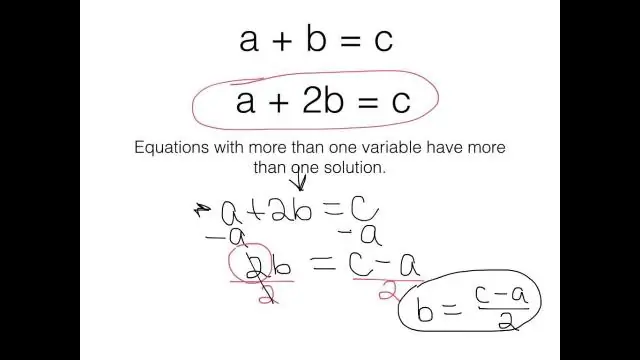
'n Algebraïese uitdrukking is 'n uitdrukking wat een of meer veranderlikes bevat. 'n Algebraïese vergelyking is 'n vergelyking wat een of meer veranderlikes bevat
Watter element maak 46,6 van die massa van die aardkors uit?

Lutgens en Edward J. Tarbuck, aardkors bestaan uit verskeie elemente: suurstof, 46,6 persent per gewig; silikon, 27,7 persent; aluminium, 8,1 persent; yster, 5 persent; kalsium, 3,6 persent; natrium, 2,8 persent, kalium, 2,6 persent, en magnesium, 2,1 persent
Wat sou 'n heuwelhelling meer stabiel maak?

Erosie, aangedryf deur swaartekrag, is die onvermydelike reaksie op daardie opheffing, en verskeie tipes erosie, insluitend massavermorsing, het hellings in die opgehewe streke geskep. Hellingstabiliteit word uiteindelik deur twee faktore bepaal: die hoek van die helling en die sterkte van die materiale daarop
Wat maak 'n element 'n metalloïed?

'n Metalloïed is 'n element wat eienskappe van beide metale en nie-metale besit, en wat dus moeilik is om te klassifiseer as óf 'n metaal óf 'n nie-metaal. Boor, silikon, germanium, arseen, antimoon en tellurium word algemeen as metalloïede erken
