
- Outeur Miles Stephen [email protected].
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Die Ideale Gaswet, soos die spreekwoord sê, is eintlik PV = nRT , met alle standaard veranderlikes. Hier is n=m/M, waar m die massa van die gas is en M die molekulêre gewig van die gas is. Kortom die R in PV = nRT word afgeskaal deur faktor M (molekulêre gewig) om die R in te kry PV = mRT.
Eenvoudig so, waaraan is r gelyk in pV nRT?
Die ideale gaswet is: pV = nRT , waar n die aantal mol is, en R is universele gaskonstante. Die waarde van R hang af van die betrokke eenhede, maar word gewoonlik met S. I.-eenhede aangegee as: R = 8,314 J/mol. Dit beteken dat jy die waarde vir lug kan gebruik R = 287 J/kg.
Net so, waarvoor staan R in chemie pV nRT? Die eenhede van die universele gaskonstante R afgelei van vergelyking PV=n R T. Dit staan vir Regnault.
In hierdie verband, waarvoor staan N in pV nRT?
. 'n Fisiese wet wat die verwantskap van die meetbare eienskappe van 'n ideale gas beskryf, waar P (druk) × V (volume) = (aantal mol) × R (die gaskonstante) × T (temperatuur in Kelvin). Dit is afgelei van 'n kombinasie van die gaswette van Boyle, Charles en Avogadro. Ook genoem universele gaswet.
Wat is M in ideale gaswet?
Die oorspronklike ideale gaswet gebruik die formule PV =nRT, die digtheidsweergawe van die ideale gaswet is PM = dRT, waar P is druk gemeet in atmosfeer (atm), T is temperatuur gemeet in kelvin (K), R is die ideale gaswet konstante 0,0821 by m (L) m ol(K) net soos in die oorspronklike formule, maar M is nou die molêre massa (g m ol
Aanbeveel:
Wat is die verskil tussen die massa van 'n proton en die massa van 'n elektron?
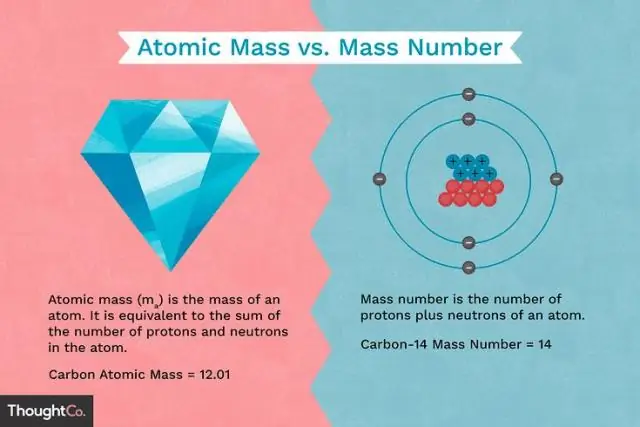
Protone en neutrone het ongeveer dieselfde massa, maar hulle is albei baie meer massief as elektrone (ongeveer 2 000 keer so massief soos 'n elektron). Die positiewe lading op 'n proton is gelyk aan die negatiewe lading op 'n elektron
Wat is die verskil tussen die puriene en die pirimidiene?

Die puriene in DNA is adenien en guanien, dieselfde as in RNA. Die pirimidiene in DNS is sitosien en timien; in RNA is dit sitosien en urasil. Puriene is groter as pirimidiene omdat hulle 'n tweeringstruktuur het terwyl pirimidiene net 'n enkele ring het
Wat is die verskil tussen energiebesparing en die beginsel van die behoud van energie?

Die kalorie-teorie het volgehou dat hitte nie geskep of vernietig kan word nie, terwyl behoud van energie die teenoorgestelde beginsel behels dat hitte en meganiese werk uitruilbaar is
Wat is die verskil tussen die Arrhenius-definisie en die brønsted Lowry-definisie van sure en basisse?

Die verskil tussen die drie teorieë is dat die Arrhenius-teorie stel dat die sure altyd H+ bevat en dat die basisse altyd OH- bevat. Terwyl die Bronsted-Lowry-model beweer dat sure protonskenkers en pron-aannemers is, hoef basisse nie OH te bevat nie, dus skenk sure 'n proton aan water wat H3O+ vorm
Wat is die verskil tussen die aarde en die wêreld?

Die aarde verwys spesifiek na die derde planeet vanaf Sol. Planeet is slegs 'n hemelliggaam in 'n wentelbaan om 'n ster. Soms gebruik mense 'wêreld' om na planete EN Aarde te verwys, maar wêreld word ook gebruik as 'n term spesifiek vir die mensdom, op die oomblik aangesien mense net een Aarde is, lyk dit of hulle baie oorvleuel
