INHOUDSOPGAWE:
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Molekulêre formules vertel jou hoeveel atome van elke element in 'n verbinding is, en empiriese formules vertel jou die eenvoudigste of mees verminderde verhouding van elemente in 'n verbinding. As 'n verbinding se molekulêre formule kan nie meer verminder word nie, dan is die empiriese formule is dieselfde as die molekulêre formule.
Eenvoudig so, hoe vind jy die molekulêre formule uit die empiriese formule?
Deel die molêre massa van die verbinding deur die empiriese formule massa. Die resultaat moet 'n heelgetal of baie naby aan 'n heelgetal wees. Vermenigvuldig al die subskripsies in die empiriese formule deur die heelgetal gevind in stap 2. Die resultaat is die molekulêre formule.
wat is die empiriese formule van 'n verbinding waarvan die molekulêre formule s6o9 is? as die molekulêre formule is S6O9 om die te kry empiriese formule ons soek 'n getal wat in 6 en 9 tot vyf die kleinste heelgetalverhouding sal verdeel (wat die definisie is van empiriese formule !).
Eenvoudig so, hoe vind jy die molekulêre formule uit die empiriese formule en molêre massa?
Empiriese formule gewig = (1 x 12.01g/mol) + (2 x 1.01g/mol) + (1 x 16.00g/mol) = 30.02g/mol. Verdeel die molêre massa vir die molekulêre formule by die empiriese formule massa . Die resultaat bepaal hoeveel keer die subskripsies in die empiriese formule om die te kry molekulêre formule.
Hoe los jy vir empiriese formule op?
Berekening van 'n Empiriese Formule
- Stap 1: Verkry die massa van elke element teenwoordig in gram. Element % = massa in g = m.
- Stap 2: Bepaal die aantal mol van elke tipe atoom teenwoordig.
- Stap 3: Deel die aantal mol van elke element deur die kleinste aantal mol.
- Stap 4: Skakel getalle om na heelgetalle.
Aanbeveel:
Hoekom is die empiriese formule van magnesiumoksied MgO?

Die empiriese formule vir magnesiumoksied is MgO. Magnesium is 'n +2 katioon en oksied is 'n -2 anioon. Aangesien die ladings gelyk en teenoorgesteld is, sal hierdie twee ione aan mekaar bind in 'n 1 tot 1 verhouding van atome
Wat is die empiriese formule van oktaan?

C8H18 Hierin, wat is die empiriese formule van oktaan c8h18? Die empiriese formule van oktaan $$C_{8}H_{18}$$ is: A. B. C. Net so, wat is die empiriese formule van c2h6o2? Molekulêre en Empiriese Formules Vraag Antwoord Skryf die empiriese formule vir die volgende verbinding:
Wat is die empiriese formule vir kafeïen?
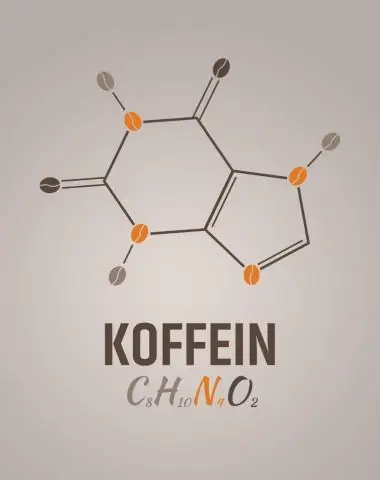
2 Antwoorde. C8H10N4O2 is die molekulêre formule vir kafeïen
Wat is die empiriese formule vir strontiumbromied?

SrBr2 Wat is dan die formule vir strontiumbromied? SrBr2 Is strontiumbromied ook waterig? Oor Strontiumbromied Heksahidraat Ultra hoë suiwerheid, hoë suiwerheid, submikron en nanopowder vorms kan oorweeg word. Meeste metaal bromied verbindings is wateroplosbaar.
Wat is die empiriese formule van 'n verbinding?

Die empiriese formule van 'n verbinding is die eenvoudigste heelgetalverhouding van elke tipe atoom in 'n verbinding. Dit kan dieselfde wees as die verbinding se molekulêre formule, maar nie altyd nie. 'n Empiriese formule kan bereken word uit inligting oor die massa van elke element in 'n verbinding of uit die persentasie samestelling
