
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Die ionisasie energie van 'n atoom is die energie verskil tussen die elektron gebind in die atoom en die elektron 'n oneindige afstand vanaf die atoom. Coulomb se wet gee die elektriese potensiële energie tussen twee puntladings met die afstand r tussen hulle. Die energie is omgekeerd eweredig aan hierdie afstand.
As u dit in ag neem, hoe hou ionisasie-energie verband met potensiële energie?
Ionisasie-energieë van die Atome. Om 'n elektron uit 'n atoom te verwyder, moet ons die verhoog potensiële energie van sy negatiewe waarde na nul. Volgens Coulomb se wet verwag ons dat elektrone nader aan die kern 'n laer sal hê potensiële energie en dus meer te vereis energie van die atoom te verwyder.
Die vraag is dan waarom ionisasie-energie drasties toeneem? Opeenvolgend ionisasie-energieë verhoog in grootte omdat die aantal elektrone, wat afstoting veroorsaak, geleidelik afneem. Dus, die bedrag van energie wat nodig is om elektrone buite die valenselektrone te verwyder, is aansienlik groter as die energie van chemiese reaksies en binding.
Gevolglik, hoe hou Coulomb se wet verband met elektronegatiwiteit?
Volgens Coulomb se wet , soos die atoomgetal toeneem binne 'n reeks atome, die kernaantrekkingskrag vir elektrone sal verhoog ook en trek dus die elektron(e) nader aan die kern. Die Coulombiese aantrekkingskrag van die kern van 'n atoom vir sy elektrone is na verwys as die elektronegatiwiteit van die atoom.
Wat is atoomionisasie-energie?
Die eerste of aanvanklike ionisasie energie of Ei van 'n atoom of molekule is die energie nodig om een mol elektrone uit een mol geïsoleerde gas te verwyder atome of ione. Jy mag dalk aan dink ionisasie energie as 'n maatstaf van die moeilikheid om elektron te verwyder of die sterkte waarmee 'n elektron gebind word.
Aanbeveel:
Hoe hou die woord matriks verband met mitochondria?
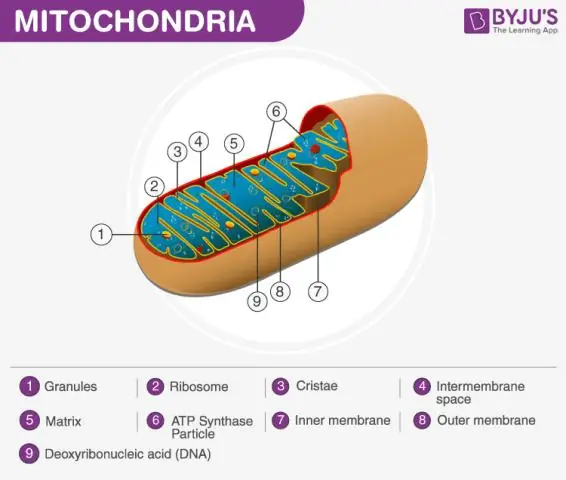
Die mitochondriale matriks Gedefinieer Die mitochondrion bestaan uit 'n buitenste membraan, 'n binnemembraan en 'n jelagtige materiaal wat die matriks genoem word. Hierdie matriks is meer viskeus as die sel se sitoplasma aangesien dit minder water bevat. Dit is 'n belangrike stap in sellulêre respirasie, wat energiemolekules genaamd ATP produseer
Hoe hou jou antwoord van vraag 1 verband met die Linnaeaanse klassifikasiestelsel?

Hoe hou jou antwoord van Vraag 1 verband met die Linnaeaanse klassifikasiestelsel? My antwoord uit vraag 1 hou verband met die Linnaen-klassifikasiestelsel deur eers die binne- en buitekant van die organisme te identifiseer. Daarna gebruik die Linneaanse klassifikasie kleur en grootte om die organisme te identifiseer
Hoe het organiese verbindings hul naam gekry. Hoe hou die woord verband met sy betekenis?
Hoe hou die woord verband met sy betekenis? Organiese verbindings kry sy naam van die aantal koolstofbindings. Die woord hou verband met die betekenis omdat dit te doen het met bindings in koolstofatome in organiese verbindings
Wat is natuurlike seleksie en hoe hou dit verband met afkoms met modifikasie?

Afkoms met modifikasie is die evolusionêre meganisme wat verandering in die genetiese kode van lewende organismes veroorsaak. Daar is drie meganismes vir sulke veranderinge en die vierde meganisme, natuurlike seleksie, bepaal watter afstammelinge oorleef om hul gene oor te dra, gebaseer op omgewingstoestande
Hoe hou die tweede wet van termodinamika verband met entropie?

Die Tweede Wet van Termodinamika bepaal dat die toestand van entropie van die hele heelal, as 'n geïsoleerde sisteem, altyd met verloop van tyd sal toeneem. Die tweede wet bepaal ook dat die veranderinge in die entropie in die heelal nooit negatief kan wees nie
