
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Elke elemente emissie spektrum is duidelik omdat elke element het 'n anders stel elektronenergievlakke. Die emissie lyne stem ooreen met die verskille tussen verskeie pare van die baie energievlakke. Die lyne (fotone) word vrygestel as elektrone van hoër-energie-orbitale na laer energieë val.
Buitendien, hoekom produseer verskillende elemente verskillende getalle spektraallyne?
Die frekwensies is kenmerkend van die eienskappe van die kern en die getalle van elektrone versprei onder die verskeie "skulpe." Volgens kwantummeganika is daar 'n maksimum nommer van elektrone toegelaat in elke gebonde dop. Dit is hoekom verskillende elemente het verskillende diskrete emissiefrekwensies.
Tweedens, hoekom is sommige spektrale lyne helderder as ander? In waterstof spektrum , sommige spektrale lyne is helderder as ander afhangende van hul energievlak. Hierdie helder lyne toon dat elektrone van hoër energievlak na laer energievlak gespring het. Dus in waterstof spektrum sommige lyne is helderder as ander.
Wat verteenwoordig die verskillende kleure in 'n lynspektrum in hierdie verband. Hoekom is die spektra vir elke element uniek?
Elke element het sy eie unieke lynspektrum en word dus na verwys as die "vingerafdruk" vir 'n bepaalde element . Die spektra vir elke element is uniek want elke element bevat verskillende getalle elektrone en dus anders energievlakke.
Waarom gee elke element 'n ander kleur uit?
Verhitting 'n atoom prikkel sy elektrone en hulle spring na hoër energievlakke. Wanneer die elektrone terugkeer na laer energievlakke, word hulle uitstraal energie in die vorm van lig. Elke element het a anders aantal elektrone en a anders stel energievlakke. Dus, elke element gee uit sy eie stel van kleure.
Aanbeveel:
Wat veroorsaak die lyne in die emissiespektrum vir elemente?

Emissielyne vind plaas wanneer die elektrone van 'n opgewekte atoom, element of molekule tussen energievlakke beweeg en na die grondtoestand terugkeer. Die spektrale lyne van 'n spesifieke element of molekule in rus in 'n laboratorium kom altyd op dieselfde golflengtes voor
Waarom verskil die absorpsiespektrum vir chlorofil a en die aksiespektrum vir fotosintese?
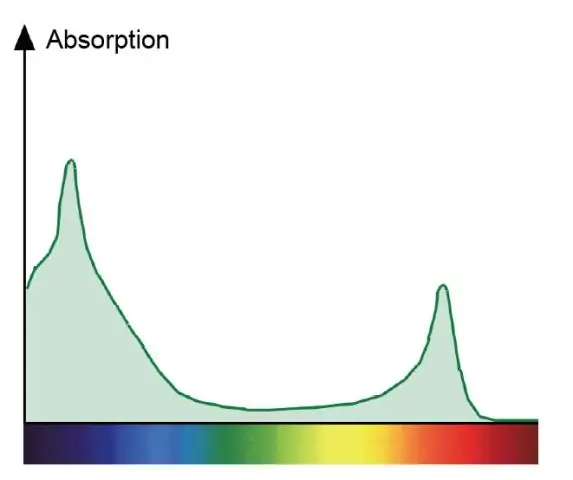
'n Absorpsiespektrum toon al die kleure lig wat deur 'n plant geabsorbeer word. 'n Aksiespektrum toon al die kleure van lig wat in fotosintese gebruik word. Chlorofille is die groen pigmente wat rooi en blou absorbeer en direk aan fotosintese deelneem
Is parallelle lyne lyne skeef?
In driedimensionele meetkunde is skewe lyne twee lyne wat nie sny nie en nie parallel is nie. Twee lyne wat albei in dieselfde vlak lê, moet mekaar kruis of parallel wees, so skewe lyne kan slegs in drie of meer dimensies bestaan. Twee lyne is skeef as en slegs as hulle nie gelykvormig is nie
Hoe kan die verskil in die helderheid van spektrale lyne wees?

In waterstofspektrum is sommige spektrale lyne helderder as ander, afhangende van hul energievlak. Wanneer elektrone van 'n hoër wentelbaan af spring, sal die energie wat in die foton vrygestel word groter wees, en ons kry 'n helderder lyn. So in waterstofspektrum is sommige lyne helderder as ander
Wat moet met elektrone gebeur om spektrale lyne te produseer?

Wanneer elektrone van 'n hoër energievlak na 'n laer een beweeg, word fotone uitgestraal, en 'n emissielyn kan in die spektrum gesien word. Absorpsielyne word gesien wanneer elektrone fotone absorbeer en na hoër energievlakke beweeg. As 'n atoom een of meer elektrone verloor het, word dit 'n ioon genoem en word gesê dat dit geïoniseer is
