
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Beperking van Dalton se wet
Die wet hou goed vir werklike gasse by lae druk, maar by hoë druk wyk dit aansienlik af. Die mengsel van gasse is nie-reaktief van aard. Daar word ook aanvaar dat die interaksie tussen die molekules van elke individuele gas dieselfde is as die molekules in die mengsel.
Op hierdie manier, wat stel Dalton se wet?
In chemie en fisika, Dalton se wet (ook genoem Dalton se wet van gedeeltelike druk) state dat in 'n mengsel van nie-reagerende gasse, die totale druk wat uitgeoefen word is gelyk aan die som van die parsiële druk van die individuele gasse.
Behalwe hierbo, hoekom is Dalton se wet belangrik? Dalton se wet is veral belangrik in atmosferiese studies. Die atmosfeer bestaan hoofsaaklik uit stikstof, suurstof, koolstofdioksied en waterdampe; die totale atmosferiese druk is die som van die parsiële druk van elke gas. Dalton se wet speel 'n groot rol in medisyne en ander asemhalingsareas.
Wat bly dan konstant in Dalton se wet?
Weereens, gebaseer op die kinetiese teorie van gasse en die ideale gas wet , Dalton se wet kan ook toegepas word op die aantal mol sodat die totale aantal mol gelyk is aan die som van die aantal mol van die individuele gasse. Hier word die druk, temperatuur en volume gehou konstant in die stelsel.
Hoe het Dalton die wet van gedeeltelike druk ontdek?
Dalton se wet Dalton se eksperimente op gasse het gelei tot sy ontdekking dat die totaal druk van 'n mengsel van gasse beloop die som van die gedeeltelike druk wat elke individuele gas uitgeoefen het terwyl dit dieselfde spasie beslaan. In 1803 het hierdie wetenskaplike beginsel amptelik bekend gestaan as Dalton se wet van gedeeltelike druk.
Aanbeveel:
Wat beteken digtheidsafhanklike beperkende faktor?
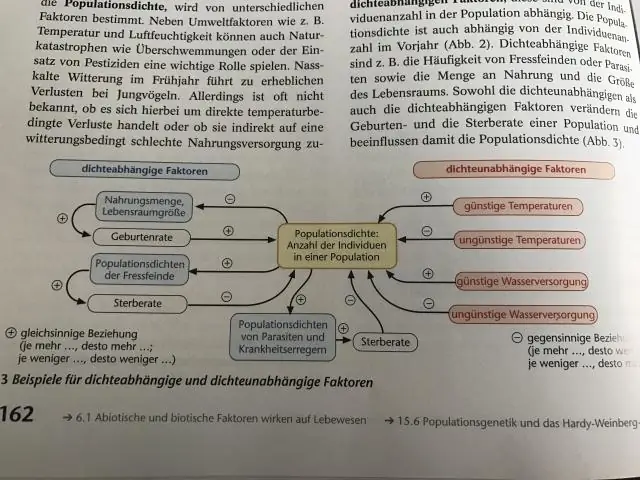
Digtheidsafhanklike beperkende faktore Die digtheidsafhanklike faktore is faktore waarvan die uitwerking op die grootte of groei van die bevolking verskil met die bevolkingsdigtheid. Daar is baie tipes digtheidsafhanklike beperkende faktore soos; beskikbaarheid van voedsel, predasie, siektes en migrasie
Waarom is Lenz se wet in ooreenstemming met die wet van behoud van energie?

Lenz se wet stem ooreen met die beginsel van behoud van energie, want wanneer 'n magneet met 'n N-pool na die spoel gedruk word (of weggetrek word van) die spoel, is daar 'n toename (of afname) in magnetiese vloedkoppeling, wat lei tot 'n geïnduseerde stroom wat in die sel vloei, volgens Faraday se wet
Wie het Dalton se wet ontdek?

John Dalton
Watter wet verduidelik die wet van behoud van massa direk?

Die wet van behoud van massa bepaal dat massa in 'n geïsoleerde sisteem nie deur chemiese reaksies of fisiese transformasies geskep of vernietig word nie. Volgens die wet van behoud van massa moet die massa van die produkte in 'n chemiese reaksie gelyk wees aan die massa van die reaktante
Waarom is ligintensiteit 'n beperkende faktor in fotosintese?

Ligintensiteit Sonder genoeg lig kan 'n plant nie baie vinnig fotosinteer nie - selfs al is daar baie water en koolstofdioksied en 'n geskikte temperatuur. Die verhoging van die ligintensiteit verhoog die tempo van fotosintese, totdat 'n ander faktor - 'n beperkende faktor - 'n tekort word
