
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-06-01 05:03.
Die hoof verskil tussen bindingsenergie en bindingsdissosiasie-energie is dit bindingsenergie is die gemiddelde bedrag van energie nodig is om al die af te breek verbande tussen dieselfde twee tipes atome in a saamgestel terwyl binding dissosiasie energie is die bedrag van energie nodig om 'n bepaalde af te breek verband inhomolise.
Hiervan, is bindingsenergie dieselfde as dissosiasie-energie?
Behalwe vir diatomiese molekules, die verband - dissosiasie energie verskil van die bondenergie . Terwyl die verband - dissosiasie energie is die energie van 'n enkele chemiese stof verband , die bondenergie is die gemiddelde van al die verband - dissosiasie-energieë van die verbande van die dieselfde tipe vir gegewe molekule.
Verder, wat is die verband tussen bindingsorde en bindingsdissosiasie-energie? Hoe hoër die verbandbevel , hoe sterker die trek tussen die twee atome en hoe korter die verband lengte. Die bindingsenergie ( binding dissosiasie energie ) is 'n maatstaf van die hoeveelheid van energie nodig om een mol kovalent-gebonde gasvormige atome uitmekaar te breek.
Eenvoudig so, wat is die verskil tussen bindingsentalpie en bindingsenergie?
Oor die algemeen, 'n positiewe verandering in entalpie word vereis om a te breek verband , terwyl 'n negatiewe verandering in entalpie gaan gepaard met die vorming van 'n verband . Met ander woorde, breek a verband is 'n endotermiese proses, terwyl die vorming van verbande is eksotermies.
Wat is bindingsenergie met voorbeeld?
In chemie, bindingsenergie (E) of verband entalpie (H) is die maatstaf van verband sterkte in 'n chemiese stof verband . Vir voorbeeld , die koolstof-waterstof bondenergie in metaan is H(C-H) die entalpieverandering betrokke by die opbreek van een molekule metaan in 'n koolstofatoom en vier waterstofradikale, gedeel deur 4.
Aanbeveel:
Wat is die verskil tussen die massa van 'n proton en die massa van 'n elektron?
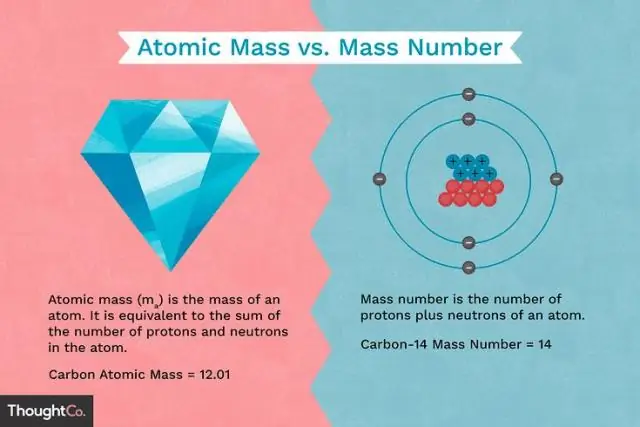
Protone en neutrone het ongeveer dieselfde massa, maar hulle is albei baie meer massief as elektrone (ongeveer 2 000 keer so massief soos 'n elektron). Die positiewe lading op 'n proton is gelyk aan die negatiewe lading op 'n elektron
Wat is die verskil tussen die puriene en die pirimidiene?

Die puriene in DNA is adenien en guanien, dieselfde as in RNA. Die pirimidiene in DNS is sitosien en timien; in RNA is dit sitosien en urasil. Puriene is groter as pirimidiene omdat hulle 'n tweeringstruktuur het terwyl pirimidiene net 'n enkele ring het
Wat is die verskil tussen die Arrhenius-definisie en die brønsted Lowry-definisie van sure en basisse?

Die verskil tussen die drie teorieë is dat die Arrhenius-teorie stel dat die sure altyd H+ bevat en dat die basisse altyd OH- bevat. Terwyl die Bronsted-Lowry-model beweer dat sure protonskenkers en pron-aannemers is, hoef basisse nie OH te bevat nie, dus skenk sure 'n proton aan water wat H3O+ vorm
Wat is die verskil tussen die aarde en die wêreld?

Die aarde verwys spesifiek na die derde planeet vanaf Sol. Planeet is slegs 'n hemelliggaam in 'n wentelbaan om 'n ster. Soms gebruik mense 'wêreld' om na planete EN Aarde te verwys, maar wêreld word ook gebruik as 'n term spesifiek vir die mensdom, op die oomblik aangesien mense net een Aarde is, lyk dit of hulle baie oorvleuel
Wat gebeur met die bindingsenergie soos die massagetal toeneem?
Die bostaande figuur illustreer dat soos die atoommassagetal toeneem, die bindingsenergie per nukleon afneem vir A > 60. Met ander woorde, die BE/A het afgeneem. Die BE/A van 'n kern is 'n aanduiding van sy graad van stabiliteit. Oor die algemeen het die meer stabiele nukliede hoër BE/A as die minder stabiele
