
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-06-01 05:03.
Arrhenius Vergelyking : ln k = -Ea/R (1/T) + ln (A)<----- dit is die y = mx + b vorm van die vergelyking , maar ek sukkel om te verstaan hoe om dit op te los. ln k = - 0,0008313/8,314 J/mol K (1/298 K ) + ln (-0.8794) <----dit is hoe ek die getalle opstel, maar ek dink nie dis reg nie
Hiervan, wat is Ln K in chemie?
lnk = ln (Ae−Ea/RT)= ln A+ ln (e−Ea/RT) lnk = ln A+−EaRT=(−EaR)(1T)+ ln A. wat die vergelyking is van 'n reguit lyn waarvan die helling -Ea /R is. Dit bied 'n eenvoudige manier om die aktiveringsenergie te bepaal uit waardes van k waargeneem by verskillende temperature, deur plot lnk as 'n funksie van 1/T.
Verder, wat is die tempokonstante k? Die tempo konstante , k , is 'n proporsionaliteit konstant wat die verband tussen die molêre konsentrasie van reaktante en die koers van 'n chemiese reaksie.
Mense vra ook, wat is die formule vir aktiveringsenergie?
Bepaling van aktiveringsenergie. Let op dat wanneer die Arrhenius-vergelyking herrangskik word soos hierbo dit 'n lineêre vergelyking is met die vorm y = mx + b; y is ln(k), x is 1/T, en m is -Ea/R. Die aktiveringsenergie vir die reaksie kan bepaal word deur die helling van die lyn.
Wat is die eenhede vir tempokonstante k?
Die eenhede van k hang af van die volgorde van die reaksie, maar die eenhede is nooit Newton per meter nie. As 'n voorbeeld, vir 'n eerste orde reaksie, k het die eenhede van 1/s en vir 'n tweede orde reaksie, eenhede van 1/M.s.
Aanbeveel:
Hoe bereken jy standaardafwyking van PMP?

Die formule wat in die PMBOK vir standaardafwyking gebruik word, is eenvoudig. Dit is net (P-O)/6. Dit is die pessimistiese aktiwiteitskatting minus die optimistiese aktiwiteitskatting gedeel deur ses. Die probleem is dat hierdie vorm of vorm geensins 'n mate van standaardafwyking produseer nie
Hoe bereken jy die omtrek van die Aarde op sy breedtegraad?

Omtrek van 'n sirkel is gelyk aan 2πr waar r sy radius is. Op die Aarde is die omtrek van die sfeer op 'n gegewe breedtegraad 2πr(cos θ) waar θ is die breedtegraad en r is die radius van die Aarde by die ewenaar
Hoe bereken jy frekwensie uit frekwensie en persentasie?
Om dit te doen, deel die frekwensie deur die totale aantal resultate en vermenigvuldig met 100. In hierdie geval is die frekwensie van die eerste ry 1 en die totale aantal resultate is 10. Die persentasie sal dan 10,0 wees. Die laaste kolom is Kumulatiewe persentasie
Hoe bereken jy potensiële daling in 'n stroombaan?
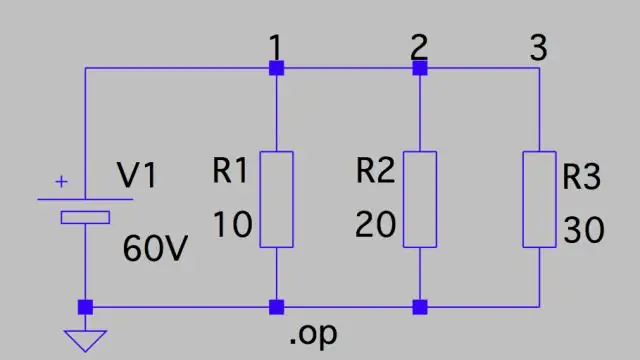
Spanningsval: Parallelle stroombaan Dit beteken dat die spanningsval oor elkeen net die totale spanning van die stroombaan is gedeel deur die aantal weerstande in die stroombaan, of 24 V/3 = 8 V
Hoe bereken jy hoe ver 'n voorwerp sal beweeg?

Horisontale afstand afgelê kan uitgedruk word as x = Vx * t, waar t die tyd is. Vertikale afstand vanaf die grond word beskryf deur die formule y = h + Vy * t – g * t² / 2, waar g die swaartekragversnelling is
