
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
In die Bohr Model , word die elektron in vaste wentelbane om die kern as apartikel behandel. Schrödinger se model (Kwantummeganiese Model ) het toegelaat dat die elektron driedimensionele ruimte beset. Dit het dus drie koördinate, of drie kwantumgetalle, vereis om die verspreiding van elektrone in die atoom te beskryf.
Net so kan 'n mens vra, hoe verskil Schrodinger se model van Bohr se vasvra?
Bohr se model wys die elektrone wat om die kern beweeg as sirkelvormige "bane". Schrödinger se model wys die elektrone wat om die kern beweeg in golfagtige bewegings wat "orbitale" genoem word. Anders atome het anders elektronkonfigurasies, dus gee hulle a anders spektra van lig.
Net so, wat is die Schrodinger-model? 'n Kragtige model van die atoom is deur Erwin ontwikkel Schrödinger in 1926. Die Schrödingermodel aanvaar dat die elektron 'n golf is en probeer om die streke in die ruimte, of orbitale, te beskryf waar elektrone waarskynlik gevind sal word.
Eenvoudig so, hoe het Schrodinger Bohr se model verander?
In die Bohr model , die elektrone is deeltjies wat slegs sekere bane van vaste energie om die kern beset. Schrödinger-model , gedra die elektrone asstaande golwe wat 'n groter waarskynlikheid het om in sommige streke van die ruimte (orbitale) te wees as in ander.
Wat is die ooreenkoms en verskil tussen Bohr-model en kwantummeganiese model?
Die Bohr model behandel die elektrone met die same-waarde as gedegenereerd, dit wil sê met dieselfde energie. Posisies beklee deur elektrone: Die hoof ooreenkoms tussen Die twee modelle is dat in beide elektrone is anders afstande vanaf die kern, wat ooreenstem met anders energieë.
Aanbeveel:
Hoe verskil die vorm van 'n plantsel van dié van 'n diersel?
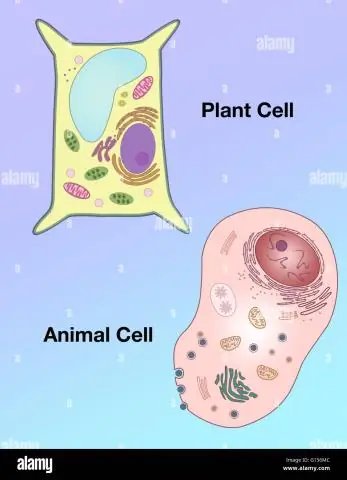
Vakuole: Plantselle het 'n groot vakuole, terwyl dierselle veelvuldige klein vakuole bevat. Vorm: Plantselle het 'n meer reëlmatige vorm (gewoonlik reghoekig), terwyl dierselle onreëlmatige vorms het. Lysosome: is oor die algemeen teenwoordig in dierselle, terwyl hulle afwesig is in plantselle
Waarom kan Bohr se model 'n planetêre model van die atoom genoem word?

Die rede waarom dit 'n 'planetêre model' genoem word, is dat die elektrone om die kern beweeg baie soos die planete om die son beweeg (behalwe dat die planete deur swaartekrag naby die son gehou word, terwyl die elektrone naby die kern gehou word deur iets wat genoem word 'n Coulomb-mag)
Hoe verskil 'n kristal van aluin van 'n kristal van kaliumaluminiumsulfaat?

A) Antwoord is: kaliumaluminiumsulfaat is kristal met kubieke struktuur, kaliumaluminiumsulfaat dodekahidraat (aluin) is hidraat (bevat water of sy samestellende elemente)
Wat is die verskil tussen Rutherford en Bohr-model?

Rutherford het die atoom beskryf as bestaande uit 'n klein positiewe massa omring deur 'n wolk negatiewe elektrone. Bohr het gedink dat elektrone in gekwantiseerde bane om die kern wentel. Hy het geglo dat elektrone om die kern beweeg in sirkelvormige bane met gekwantiseerde potensiaal en kinetiese energieë
Hoe verskil die lewensiklus van 'n varing van die lewensiklus van 'n mos?

Verskille: -- Mosse is nie-vaskulêre plante; varings is vaskulêr. -- Gametofiet is die dominante generasie in mosse; sporofiet is dominante generasie in varings. -- Mosse het aparte manlike en vroulike gametofiete; varinggametofiete het manlike en vroulike dele op dieselfde plant
