- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Van bo na onder af a groep , neem elektronegatiwiteit af. Dit is omdat atoom getal styg af a groep , en dus is daar 'n groter afstand tussen die valenselektrone en kern, of 'n groter atoom radius.
As u dit in ag neem, waarom neem atoomgrootte toe in 'n groep?
Oor die algemeen, atoom radius verminder oor 'n tydperk en vermeerder 'n groep af . Af 'n groep , die aantal energievlakke (n) verhogings , so daar is 'n groter afstand tussen die kern en die buitenste orbitaal. Dit lei tot 'n groter atoom radius.
Ook, wat is die neiging in 1ste ionisasie-energie van bo na onder in 'n groep? Beweeg links na regs oor 'n tydperk, atoom radius neem af, dus word elektrone meer aangetrek na die (nadere) kern. Die algemene neiging is dat ionisasie-energie afneem, beweeg van bo na onder na onder in 'n periodieke tabelgroep. Deur 'n groep af te beweeg, word 'n valensdop bygevoeg.
Weet ook, wat is die periodieke tendens in die variasie van Valency terwyl 'n groep afneem?
» Alle lede van 'n groep dieselfde aantal valenselektrone hê. » Die atoomradius neem gewoonlik toe terwyl jy 'n groep afgaan as gevolg van die byvoeging van 'n nuwe energievlak (dop).
Watter neiging in atoomradius sien jy as jy na 'n groepfamilie op die periodieke tabel gaan?
’n Sterker kernpakke trek elektrone nader, pak hulle stywer saam en, uiteindelik, verminder die atoom radius . Soos jy gaan af a familie op die periodieke tabel , neem ionisasie-energie af. Die aantal energievlakke neem toe as jy gaan af die periodieke tabel.
Aanbeveel:
Wat is die definisie van 'n groep op die periodieke tabel?

In chemie is 'n groep (ook bekend as 'n familie) 'n kolom van elemente in die periodieke tabel van die chemiese elemente. Daar is 18 genommerde groepe in die periodieke tabel; die f-blokkolomme (tussen groepe 3 en 4) is nie genommer nie
Wat is die naam vir die groep Vierhoeke vir wie al vier die hoeke 90 is?

Dit is die 'ouer' van sommige ander vierhoeke, wat verkry word deur beperkings van verskillende soorte by te voeg: 'n Reghoek is 'n parallelogram maar met al vier binnehoeke vas op 90°. 'n Ruim is 'n parallelogram maar met al vier sye ewe lank
Wat is die neiging in elektronegatiwiteit wat 'n groep afneem?
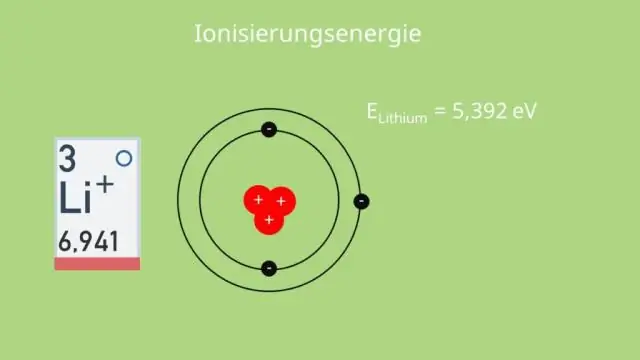
Dus, soos jy 'n groep op die periodieke tabel afbeweeg, verminder die elektronegatiwiteit van 'n element omdat die verhoogde aantal energievlakke die buitenste elektrone baie ver van die trekkrag van die kern plaas. Elektronegatiwiteit neem toe soos jy van links na regs oor 'n tydperk op die periodieke tabel beweeg
Wat is die maatstawwe van sentrale neiging vir ongegroepeerde data?
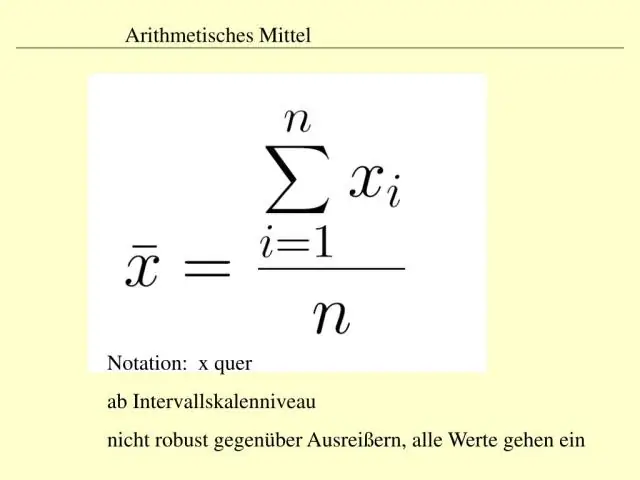
Die term sentrale neiging verwys na die middel, of tipiese, waarde van 'n stel data, wat die meeste gemeet word deur die drie m's te gebruik: gemiddelde, mediaan en modus. Die gemiddelde, mediaan en modus staan bekend as die maatstawwe van sentrale neiging
Waar is die atoomgrootte op 'n periodieke tabel?

Daar is drie faktore wat help in die voorspelling van die tendense in die Periodieke Tabel: aantal protone in die kern, aantal skulpe en afskermingseffek. Die atoomgrootte neem toe van bo na onder in enige groep as gevolg van toenames in al die drie faktore
