
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
So, soos jy beweeg 'n groep af op die periodieke tabel, die elektronegatiwiteit van 'n element afneem omdat die verhoogde aantal energievlakke die buitenste elektrone baie ver van die trekkrag van die kern plaas. Elektronegatiwiteit neem toe soos jy van links na regs beweeg oor 'n tydperk op die periodieke tabel.
Wat dit betref, hoekom neem elektronegatiwiteit oor 'n groep af?
Elektronegatiwiteit . Beweeg af in 'n groep , die elektronegatiwiteit neem af as gevolg van die langer afstand tussen die kern en die valenselektronskil, waardeur die aantrekkingskrag verminder word, wat die atoom minder aantrekkingskrag vir elektrone of protone maak.
Die vraag is dan, het elektronegatiwiteit 'n neiging? Hoe hoër die elektronegatiwiteit van 'n atoom, hoe groter is sy vermoë om gedeelde elektrone aan te trek. Die elektronegatiwiteit aantal atome neem toe soos jy van links na regs beweeg oor 'n tydperk in die periodieke tabel. Die elektronegatiwiteit van atome verminder soos jy van bo na onder na onder in 'n groep in die periodieke tabel beweeg.
'n Mens kan ook vra, wat is die neiging in ionisasie-energie wat 'n groep afneem?
Beweeg links na regs oor 'n tydperk, atoomradius verminder, sodat elektrone meer na die (nader) kern aangetrek word. Die generaal neiging is vir ionisasie energie om beweging van bo na onder te verminder af 'n periodieke tabel groep . Beweeg 'n groep af , word 'n valensdop bygevoeg.
Wat is die neiging in atoomgetal wat 'n groep afneem?
- Die nommer van energievlakke verhoog soos jy beweeg 'n groep af as die nommer van elektrone toeneem. Elke daaropvolgende energievlak is verder van die kern as die laaste. Daarom is die atoom radius neem toe soos die groep en energievlakke verhoog. 2) Soos jy oor 'n tydperk beweeg, atoom radius verminder.
Aanbeveel:
Hoekom het halogene hoë elektronegatiwiteit?

As gevolg van hul hoë effektiewe kernlading, is halogene hoogs elektronegatief. Daarom is hulle hoogs reaktief en kan 'n elektron verkry deur reaksie met ander elemente. Halogene kan in voldoende hoeveelhede skadelik of dodelik wees vir biologiese organismes
Wat is die tweede ionisasie-energie-neiging?

Ionisasie-energie-tendense in die periodieke tabel. Die ionisasie-energie van 'n atoom is die hoeveelheid energie wat benodig word om 'n elektron uit die gasvorm van daardie atoom of ioon te verwyder. Die tweede ionisasie-energie is byna tien keer dié van die eerste omdat die aantal elektrone wat afstotings veroorsaak, verminder word
Wat is die periodieke neiging vir atoomgrootte van bo na onder in 'n groep?

Van bo na onder in 'n groep neem elektronegatiwiteit af. Dit is omdat atoomgetal afwaarts in 'n groep toeneem, en dus is daar 'n groter afstand tussen die valenselektrone en kern, of 'n groter atoomradius
Wat is die maatstawwe van sentrale neiging vir ongegroepeerde data?
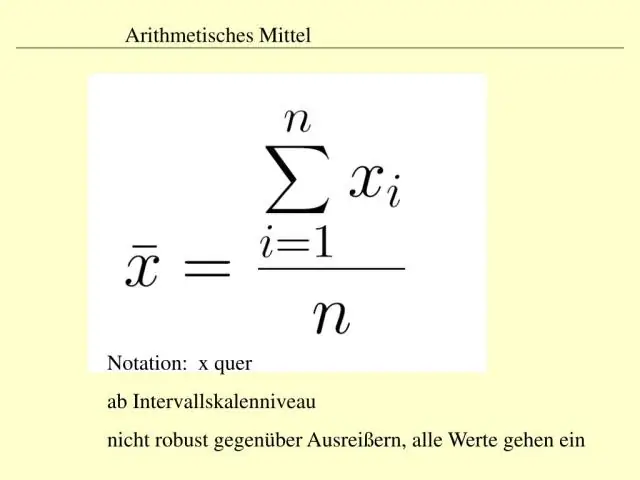
Die term sentrale neiging verwys na die middel, of tipiese, waarde van 'n stel data, wat die meeste gemeet word deur die drie m's te gebruik: gemiddelde, mediaan en modus. Die gemiddelde, mediaan en modus staan bekend as die maatstawwe van sentrale neiging
Wat is die elektronegatiwiteit van h2o?

Water, 'n Polêre binding Waterstof het 'n elektronegatiwiteit van 2,0, terwyl suurstof 'n elektronegatiwiteit van 3,5 het. Die verskil in elektronegatiwiteite is 1,5, wat beteken dat water 'n polêre kovalente molekule is
