
INHOUDSOPGAWE:
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
By die toewysing elektrone aan orbitale , ons moet 'n stel van volg drie reëls : die Aufbau-beginsel, die Pauli-uitsluitingsbeginsel en Hund's Reël.
In hierdie verband, wat is die drie reëls wat die vul van atoomorbitale deur elektronevasvrae beheer?
Drie reëls -die aufbau-beginsel, die Pauli-uitsluitingsbeginsel en Hund s'n reël -vertel jou hoe om die te vind elektron konfigurasies van atome . Volgens die aufbau-beginsel, elektrone beset die orbitale van die laagste energie eerste. In die aufbau-diagram verteenwoordig elke boks 'n atoomorbitaal.
Tweedens, watter chemiewet beskryf die vulling van orbitale deur elektrone in 'n atoom? Volgens Hund se reël, orbitale van dieselfde energie is elk gevul met een elektron voor vulsel enige met 'n sekonde. Ook hierdie eerste elektrone het dieselfde draai. Hierdie reël word soms die "bussitplekreël" genoem.
Vervolgens kan mens ook vra, wat is die drie reëls vir die vul van orbitale?
Reël 1 - Laagste energie orbitale vul eerste. Dus, die vulsel patroon is 1s, 2s, 2p, 3s, 3p, 4s, 3d, ens. Aangesien die orbitale binne 'n onderdop is gedegenereer (van gelyke energie), die hele onderdop van 'n bepaalde orbitaal tipe is gevul voordat jy na die volgende subdop van hoër energie beweeg.
Wat is die drie reëls vir atome?
Bepalings in hierdie stel (3)
- Aufbau-beginsel. Elektrone moet eers die laagste energieorbitale vul.
- Pauli-uitsluitingsbeginsel. nie meer as twee elektrone kan dieselfde orbitaal beset nie.
- Hund se reël. wanneer elektrone orbitale van gelyke energie beset, koppel hulle nie totdat dit moet nie.
Aanbeveel:
Wat is die naam van die sout wat gevorm word deur die neutralisasie van soutsuur en natriumhidroksied?
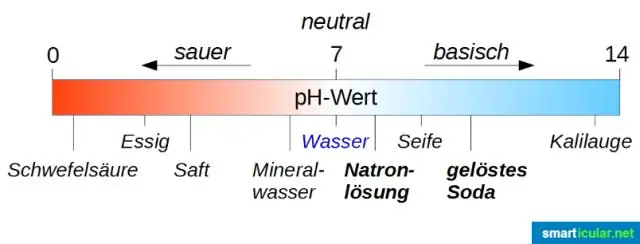
Verduideliking: Die reaksie tussen natriumhidroksied (NaOH) en soutsuur (HCl) is 'n neutralisasiereaksie wat lei tot die vorming van 'n sout, natriumchloried (NaCl) en water (H2O). Dit is 'n eksotermiese reaksie
Wat is drie maniere waarop eukariotiese selle geenuitdrukking kan beheer?

Eukariotiese geenuitdrukking kan in baie stadiums Chromatientoeganklikheid gereguleer word. Die struktuur van chromatien (DNS en sy organiserende proteïene) kan gereguleer word. Transkripsie. Transkripsie is 'n belangrike regulatoriese punt vir baie gene. RNA verwerking
Wat is die naam van die groot netwerk in die liggaam wat geenuitdrukking beheer?

VERTELLER: Hierdie merkers en ander beheer geenuitdrukking deur 'n groot netwerk in die liggaam wat die epigenoom genoem word. RANDY JIRTLE: Epigenetika vertaal letterlik in net betekenis bo die genoom
Wat is 'n positiewe beheer en 'n negatiewe beheer in gelelektroforese?

Positiewe en negatiewe kontroles is monsters wat gebruik word om die geldigheid van die gelelektroforese-eksperiment te bevestig. Positiewe kontroles is monsters wat bekende fragmente van DNA of proteïen bevat en op 'n spesifieke manier op die jel migreer. 'n Negatiewe kontrole is 'n monster wat geen DNA of proteïen bevat nie
Hoe kan morfogenese beïnvloed word deur die beheer van geenuitdrukking?

Geenuitdrukking beïnvloed morfogenese deur te reguleer hoe die organisme gaan uitkom. Hoe verskil seldifferensiasie van morfogenese? seldifferensiasie is wanneer stamselle verskillende tipes selle word, bv: vel, bloed, bene, ens. Morfogenese is die ontwikkeling van liggaamsdele
