
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Volgens Coulomb se wet, soos die atoom aantal toenames binne 'n reeks van atome , die kern aantrekkingskrag want elektrone sal ook toeneem en sodoende die elektron(e) nader aan die kern trek. So 'n verhouding tussen atoom nommer en atoom radius is 'n direkte korrelasie.
Net so, wat is die verwantskap tussen atoomgetal en atoomradius?
Die atoomgetal is die hoeveelheid protone teenwoordig in die atoom . As gevolg daarvan kan ons sê dat die atoomgetal verteenwoordig die positiewe lading van die atoom . As die positiewe lading van die atoom verhoog die atoom radius neem af omdat die positiewe lading elektrone nader aan die kern sal bring.
Mens kan ook vra wat is coulombiese krag en hoe word dit deur kernlading beïnvloed? Die effektiewe kernlading van 'n atoom is die netto positief hef 'gevoel' deur die VALENSE-elektron. Dit beteken om die aantreklike in ag te neem magte gevoel tussen die protone en elektrone sowel as die replusive magte gevoel tussen die valenselektrone en die kern (binne) elektrone.
As u dit in ag neem, waarvan hang coulombiese aantrekkingskrag af?
Hierdie Coulombiese aantrekkingskrag veroorsaak dat elektrone om die kern wentel.) Die sterkte van die coulombiese aantrekkingskrag hang af van twee dinge: Die grootte van die atoom. Die totale lading van die atoom.
Wat is die verband tussen coulombiese aantrekking en ionisasie-energie?
Hoe groter die ionisasie energie , hoe moeiliker is dit aan verwyder 'n elektron. Gebruik dieselfde Coulombiese aantrekkingskrag idees, kan ons die eerste verduidelik ionisasie energie tendense op die periodieke tabel. Die neiging van 'n atoom in 'n molekule aan gedeelde elektrone aantrek aan self word elektronegatiwiteit genoem.
Aanbeveel:
Hoe hou die woord matriks verband met mitochondria?
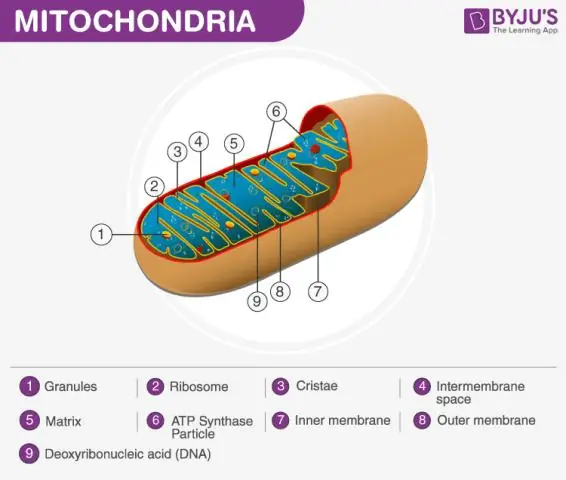
Die mitochondriale matriks Gedefinieer Die mitochondrion bestaan uit 'n buitenste membraan, 'n binnemembraan en 'n jelagtige materiaal wat die matriks genoem word. Hierdie matriks is meer viskeus as die sel se sitoplasma aangesien dit minder water bevat. Dit is 'n belangrike stap in sellulêre respirasie, wat energiemolekules genaamd ATP produseer
Hoe hou jou antwoord van vraag 1 verband met die Linnaeaanse klassifikasiestelsel?

Hoe hou jou antwoord van Vraag 1 verband met die Linnaeaanse klassifikasiestelsel? My antwoord uit vraag 1 hou verband met die Linnaen-klassifikasiestelsel deur eers die binne- en buitekant van die organisme te identifiseer. Daarna gebruik die Linneaanse klassifikasie kleur en grootte om die organisme te identifiseer
Hoe het organiese verbindings hul naam gekry. Hoe hou die woord verband met sy betekenis?
Hoe hou die woord verband met sy betekenis? Organiese verbindings kry sy naam van die aantal koolstofbindings. Die woord hou verband met die betekenis omdat dit te doen het met bindings in koolstofatome in organiese verbindings
Wat is natuurlike seleksie en hoe hou dit verband met afkoms met modifikasie?

Afkoms met modifikasie is die evolusionêre meganisme wat verandering in die genetiese kode van lewende organismes veroorsaak. Daar is drie meganismes vir sulke veranderinge en die vierde meganisme, natuurlike seleksie, bepaal watter afstammelinge oorleef om hul gene oor te dra, gebaseer op omgewingstoestande
Hoe beïnvloed coulombiese aantrekking ionisasie-energie?

Hoe groter die ionisasie-energie, hoe moeiliker is dit om 'n elektron te verwyder. Deur dieselfde Coulombiese aantrekkingsidees te gebruik, kan ons die eerste ionisasie-energie-tendense op die periodieke tabel verduidelik. Hoe groter 'n atoom se elektronegatiwiteit, hoe groter is sy vermoë om elektrone na homself te lok
