
INHOUDSOPGAWE:
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Titrasieprobleem Stap-vir-stap oplossing
- Stap 1: Bepaal [OH-] Elke mol NaOH sal een mol OH hê-.
- Stap 2: Bepaal die aantal mol OH- Molariteit = aantal mol/volume.
- Stap 3: Bepaal die aantal mol H+
- Stap 4: Bepaal die konsentrasie HCl.
Net so kan 'n mens vra, hoe bereken jy titrasie?
Gebruik die titrasie formule. As die titrant en analiet 'n 1:1 molverhouding het, is die formule molariteit (M) van die suur x volume (V) van die suur = molariteit (M) van die basis x volume (V) van die basis. (Molariteit is die konsentrasie van 'n oplossing uitgedruk as die aantal mol opgeloste stof per liter oplossing.)
Behalwe hierbo, wat is die molariteit van NaOH? Byvoorbeeld, 'n 0,25 M NaOH oplossing (dit word gelees as 0,25 molêr) bevat 0,25 mol van natriumhidroksied in elke liter oplossing. Elke keer as jy die afkorting M sien, moet jy dadelik daaraan dink as mol/L.
Hiervan, hoe vind jy die konsentrasie HCl uit titrasie met NaOH?
Bereken die konsentrasie van die soutsuur
- Volume natriumhidroksiedoplossing = 25.00 ÷ 1000 = 0.0250 dm 3
- Hoeveelheid natriumhidroksied = 0,200 × 0,0250 = 0,005 mol.
- Uit die vergelyking reageer 0,005 mol NaOH met 0,005 mol HCl.
- Volume soutsuur = 22,70 ÷ 1000 = 0,0227 dm 3
Wat is aanwyser in titrasie?
Aanwyser : 'n Stof wat van kleur verander in reaksie op 'n chemiese verandering. 'n Suur-basis aanwyser (bv. fenolftaleïen) verander kleur na gelang van die pH. Redoks aanwysers word ook gebruik. 'n Druppel van aanwyser oplossing word by die titrasie Aan die begin; die eindpunt is bereik wanneer die kleur verander.
Aanbeveel:
Hoe bereken jy standaardafwyking van PMP?

Die formule wat in die PMBOK vir standaardafwyking gebruik word, is eenvoudig. Dit is net (P-O)/6. Dit is die pessimistiese aktiwiteitskatting minus die optimistiese aktiwiteitskatting gedeel deur ses. Die probleem is dat hierdie vorm of vorm geensins 'n mate van standaardafwyking produseer nie
Hoe bereken jy die omtrek van die Aarde op sy breedtegraad?

Omtrek van 'n sirkel is gelyk aan 2πr waar r sy radius is. Op die Aarde is die omtrek van die sfeer op 'n gegewe breedtegraad 2πr(cos θ) waar θ is die breedtegraad en r is die radius van die Aarde by die ewenaar
Hoe bereken jy frekwensie uit frekwensie en persentasie?
Om dit te doen, deel die frekwensie deur die totale aantal resultate en vermenigvuldig met 100. In hierdie geval is die frekwensie van die eerste ry 1 en die totale aantal resultate is 10. Die persentasie sal dan 10,0 wees. Die laaste kolom is Kumulatiewe persentasie
Hoe bereken jy potensiële daling in 'n stroombaan?
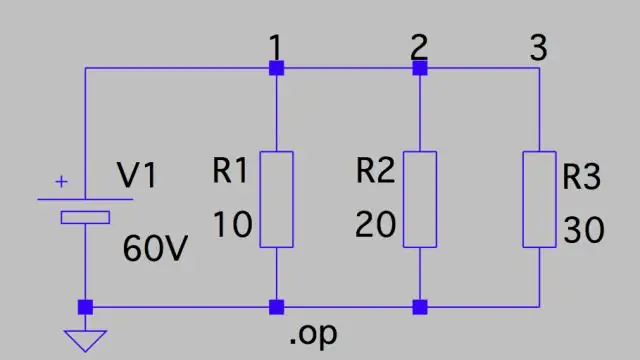
Spanningsval: Parallelle stroombaan Dit beteken dat die spanningsval oor elkeen net die totale spanning van die stroombaan is gedeel deur die aantal weerstande in die stroombaan, of 24 V/3 = 8 V
Hoe bereken jy hoe ver 'n voorwerp sal beweeg?

Horisontale afstand afgelê kan uitgedruk word as x = Vx * t, waar t die tyd is. Vertikale afstand vanaf die grond word beskryf deur die formule y = h + Vy * t – g * t² / 2, waar g die swaartekragversnelling is
