
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
As jy moet gebruik hierdie vergelyking , vind net die "ln"-knoppie op jou sakrekenaar. Jy kan gebruik die Arrhenius-vergelyking om die effek van 'n verandering van temperatuur op die tempokonstante - en dus op die tempo van die reaksie, aan te toon. As die tempokonstante byvoorbeeld verdubbel, sal die tempo van die reaksie ook so verdubbel.
Net so, wat is die formule vir aktiveringsenergie?
Bepaling van aktiveringsenergie. Let op dat wanneer die Arrhenius-vergelyking herrangskik word soos hierbo dit 'n lineêre vergelyking is met die vorm y = mx + b; y is ln(k), x is 1/T, en m is -Ea/R. Die aktiveringsenergie vir die reaksie kan bepaal word deur die te vind helling van die lyn.
Daarbenewens, wat is die eenhede vir K? Uit die patroon van eenhede ons kan stel dat vir 'n reaksie van kinetiese orde n, die eenhede van k is: k = 1/tc^(n-1), onthou dat c die hoeveelheid per liter uitgedruk in massa of molariteit is en n die kinetiese orde is.
Wat is dan die eenhede van aktiveringsenergie in die Arrhenius-vergelyking?
waar k die tempokonstante voorstel, Ea is die aktiveringsenergie , R is die gaskonstante (8,3145 J/K mol), en T is die temperatuur uitgedruk in Kelvin. A staan bekend as die frekwensiefaktor, met eenhede van L mol-1 s-1, en neem die frekwensie van reaksies en waarskynlikheid van korrekte molekulêre oriëntasie in ag.
Wat is die tempokonstante k?
Die tempo konstante , k , is 'n proporsionaliteit konstant wat die verband tussen die molêre konsentrasie van reaktante en die koers van 'n chemiese reaksie. Die tempo konstante kan eksperimenteel gevind word deur die molêre konsentrasies van die reaktante en die volgorde van reaksie te gebruik.
Aanbeveel:
Hoe vind jy die benaderde persentasie deur die empiriese reël te gebruik?

Vind die oppervlakte onder die kromme van x = 9 tot x = 13. Die Empiriese Reël of 68-95-99.7% Reël gee die benaderde persentasie data wat binne een standaardafwyking (68%), twee standaardafwykings (95%) val , en drie standaardafwykings (99,7%) van die gemiddelde
Hoe word die traagheidswet in die alledaagse lewe gebruik?
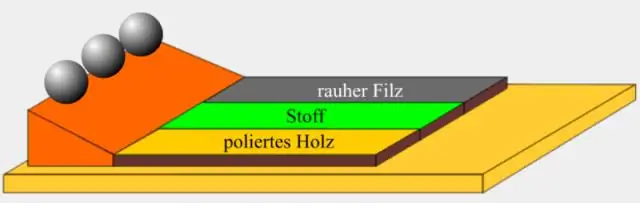
'n Mens se liggaamsbeweging na die kant toe wanneer 'n motor 'n skerp draai maak. Aantrek van veiligheidsgordels in 'n motor wanneer dit vinnig stop. 'n Bal wat teen 'n heuwel afrol, sal aanhou rol tensy wrywing of 'n ander krag dit stop. Traagheid veroorsaak dit deur die voorwerp te laat voortbeweeg in die rigting wat dit was
Wat is die verskil tussen die Arrhenius-definisie en die brønsted Lowry-definisie van sure en basisse?

Die verskil tussen die drie teorieë is dat die Arrhenius-teorie stel dat die sure altyd H+ bevat en dat die basisse altyd OH- bevat. Terwyl die Bronsted-Lowry-model beweer dat sure protonskenkers en pron-aannemers is, hoef basisse nie OH te bevat nie, dus skenk sure 'n proton aan water wat H3O+ vorm
Wanneer moet jy die aktiwiteitsreeks gebruik hoe gebruik jy dit?

Dit word gebruik om die produkte van enkelverplasingsreaksies te bepaal, waardeur metaal A 'n ander metaal B in 'n oplossing sal vervang as A hoër in die reeks is. Aktiwiteitsreeks van sommige van die meer algemene metale, gelys in dalende volgorde van reaktiwiteit
Hoe vind jy die area van die gesig deur die oppervlakte te gebruik?

Oppervlakte is die som van die oppervlaktes van alle vlakke (of oppervlaktes) op 'n 3D-vorm. 'n Kubus het 6 reghoekige vlakke. Om die oppervlakte van 'n blokkie te vind, voeg die oppervlaktes van al 6 vlakke by. Ons kan ook die lengte (l), breedte (w) en hoogte (h) van die prisma benoem en die formule, SA=2lw+2lh+2hw, gebruik om die oppervlakte te vind
