
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Niels Bohr verduidelik die lyn spektrum van die waterstof atoom deur te aanvaar dat die elektron in sirkelvormige bane beweeg en dat bane met slegs sekere radiusse toegelaat is. Die baan naaste aan die kern het die grondtoestand van die atoom en was die mees stabiele; wentelbane verder weg was hoër-energie opgewekte toestande.
Wat verduidelik Bohr se model eweneens?
Die Bohr model wys dat die elektrone in atome in wentelbane van verskillende energie om die kern is (dink aan planete wat om die son wentel). Bohr het die term energievlakke (of skulpe) gebruik om hierdie bane van verskillende energie te beskryf.
Verder, hoe lees jy 'n Bohr-model?
- Teken die kern.
- Skryf die aantal neutrone en die aantal protone in die kern neer.
- Teken die eerste energievlak.
- Teken die elektrone in die energievlakke volgens die reëls hieronder.
- Hou tred met hoeveel elektrone in elke vlak geplaas word en die aantal elektrone wat oorbly om te gebruik.
Net so kan 'n mens vra, hoe word 'n atoomspektra geproduseer?
Wanneer atome is opgewonde, straal hulle lig uit van sekere golflengtes wat ooreenstem met verskillende kleure. Die uitgestraalde lig kan waargeneem word as 'n reeks gekleurde lyne met donker spasies tussenin; hierdie reeks gekleurde lyne word 'n lyn of genoem atoomspektra . Elke element produseer 'n unieke stel van spektraal lyne.
Wat is die gevolgtrekking wat Bohr in sy model gemaak het om die lynspektrum van waterstof te verduidelik?
Verduideliking: Bohr hierdie aanname gebaseer op die feit dat daar slegs 'n paar is lyne in die spektrum van die waterstof atoom en hy het geglo dat die lyne was die gevolg van lig wat vrygestel of geabsorbeer word as 'n elektron wat van een wentelbaan na 'n ander in die atoom beweeg het.
Aanbeveel:
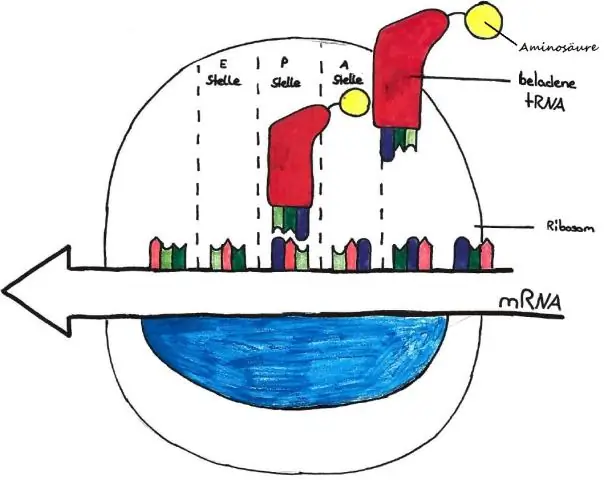
Hoe word die vertaling van mRNA beëindig verklaar?

Translasie van mRNA word beëindig wanneer 'n stopkodon (UAA, UAG, UGA) 'n plek van ribosoom beset. Stopkodons word nie deur tRNA's herken nie en dus bind 'n vrystellingsfaktor (RF) proteïen aan die kompleks en hidroliseer die binding tussen laaste tRNA en aminosuur
Hoe verklaar jy outokorrelasie?

Outokorrelasie verteenwoordig die mate van ooreenkoms tussen 'n gegewe tydreeks en 'n vertraagde weergawe van homself oor opeenvolgende tydintervalle. Outokorrelasie meet die verhouding tussen 'n veranderlike se huidige waarde en sy vorige waardes
Hoe verklaar natuurlike seleksie afkoms met modifikasie?
Afkoms met modifikasie is die evolusionêre meganisme wat verandering in die genetiese kode van lewende organismes veroorsaak. Daar is drie meganismes vir sulke veranderinge en die vierde meganisme, natuurlike seleksie, bepaal watter afstammelinge oorleef om hul gene oor te dra, gebaseer op omgewingstoestande
Hoe verklaar meiose Mendel se wet van segregasie?

In wese bepaal die wet dat kopieë van gene skei of skei sodat elke gameet slegs een alleel ontvang. Aangesien chromosome tydens meiose in verskillende gamete skei, skei die twee verskillende allele vir 'n bepaalde geen ook sodat elke gameet een van die twee allele verkry
Hoe verklaar die vuurtoringmodel pulsars?

Verduidelik pulsars as draaiende neutronsterre wat strale van straling vanaf hul magnetiese pole uitstraal. Terwyl hulle tol, vee hulle die balke om die lug soos vuurtorings; as die strale oor die aarde vee, bespeur sterrekundiges pulse. Wanneer 'n supernova ontplof, stort die kern ineen tot 'n baie klein grootte
