- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Die gemiddelde atoommassa vir 'n element is bereken deur die opsomming van die massas van die element se isotope, elkeen vermenigvuldig met sy natuurlike oorvloed op aarde. Wanneer jy enige massa berekeninge wat elemente of verbindings insluit, gebruik altyd gemiddelde atoommassa , wat gevind kan word op die periodieke tabel.
Hoe word die atoommassas op die periodieke tabel daarvan bepaal?
Saam, die aantal protone en die aantal neutrone bepaal an element se massa nommer. Sedert 'n element se isotope het effens anders massa getalle, die atoommassa is bereken deur die gemiddelde van die te verkry massa getalle vir sy isotope.
Verder, watter element dien as basis vir die atoommassasisteem? Dalton het waterstof gekies as die standaard vir sy tabel van atoommassas en het die waterstofatoom a gegee massa van 1. Natuurlik kon hy enige ander gekies het element en enige ander waarde vir sy atoommassa . Maar waterstof was die ligste van die elemente en 1 is die maklikste getal om vergelykings te tref.
Net so word gevra, watter isotoop het 'n atoommassa naaste aan die gemiddelde atoommassa wat op die periodieke tabel gelys is?
Al die massas van die elemente word relatief tot 12C bepaal. Aangesien baie elemente het n aantal isotope , chemici gebruik gemiddelde atoommassa . Op die periodieke tabel die massa koolstof word gerapporteer as 12,011 amu.
Is die atoommassa op die periodieke tabel?
Die standaard atoom gewig is die gemiddelde massa van 'n element in atoommassa eenhede ("amu"). Alhoewel individueel atome altyd 'n heelgetal hê nommer van atoommassa eenhede, die atoommassa op die periodieke tabel word as 'n desimaal aangegee nommer want dit is 'n gemiddelde van die verskillende isotope van 'n element.
Aanbeveel:
Wat is die gemiddelde atoommassa van 'n atoom?

Die gemiddelde atoommassa van 'n element is die som van die massas van sy isotope, elk vermenigvuldig met sy natuurlike oorvloed (die desimale wat geassosieer word met persentasie atome van daardie element wat van 'n gegewe isotoop is). Gemiddelde atoommassa = f1M1 + f2M2 +
Wat word 'n vierkant op die periodieke tabel genoem?

24 Jan 2016. Elke vierkant op die periodieke tabel gee ten minste die naam van die element, sy simbool, atoomgetal en relatiewe atoommassa (atoomgewig)
Hoe bereken jy die gemiddelde atoommassa van strontium?
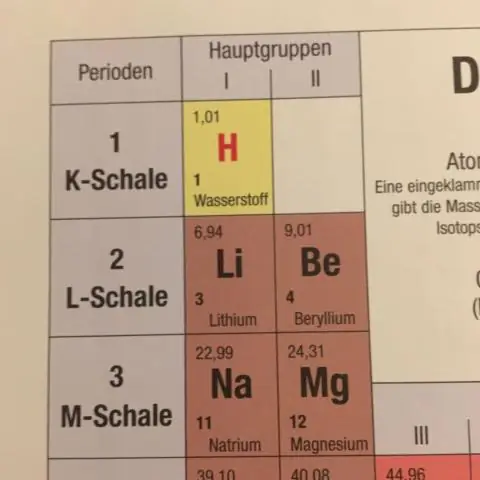
Dus, ons bereken dit deur die geweegde massa van elk van die isotope te neem en hulle bymekaar te tel. Dus, vir die eerste massa, vermenigvuldig ons 0,50% van 84 (amu - atoommassa-eenhede) = 0,042 amu, en voeg dit by 9,9% van 86 amu = 8,51 amu, ensovoorts
Waarom word massagetalle nie op die periodieke tabel gelys nie?

Die som van die aantal protone en neutrone in 'n atoom word die massagetal genoem. Atoommassa is om verskeie redes nooit 'n heelgetal getal nie: Die atoommassa wat op 'n periodieke tabel gerapporteer word, is die geweegde gemiddelde van al die isotope wat natuurlik voorkom. As dit 'n gemiddelde is, sal dit baie onwaarskynlik wees om 'n heelgetal te wees
Waarom word die periodieke tabel volgens atoomgetal gerangskik en nie volgens atoommassa nie?

Waarom word die Periodieke Tabel volgens atoomgetal gerangskik en nie volgens atoommassa nie? Atoomgetal is die aantal protone in die kern van elke element se atome. Daardie nommer is uniek aan elke element. Atoommassa word bepaal deur die aantal protone en neutrone saam
