
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
So, ons bereken dit deur die geweegde te neem massa van elk van die isotope en hulle saam te voeg. So, vir die eerste massa , sal ons 0,50% van 84 vermenigvuldig (amu - atoommassa eenhede) = 0,042 amu, en voeg dit by 9,9% van 86 amu = 8,51 amu, ensovoorts.
Vervolgens kan mens ook vra, hoe bereken jy die gemiddelde atoommassa?
Berekening van gemiddelde atoommassa Die gemiddelde atoommassa van 'n element is die som van die massas van sy isotope, elk vermenigvuldig met sy natuurlike oorvloed (die desimale wat geassosieer word met persentasie van atome van daardie element wat van 'n gegewe isotoop is). Gemiddelde atoommassa = f1M1 + f2M2 +…
Weet ook watter drie tipes inligting is nodig om 'n gemiddelde atoommassa te bereken? Die aantal isotope wat vir die element bestaan. Die Atoom Nommer vir die element. Die persentasie oorvloed van elke isotoop.
Mens kan ook vra, watter waarde is die naaste aan die atoommassa van strontium?
Strontium . In sy 1961-verslag het die Kommissie aanbeveel dat Ar(Sr) = 87.62 gebaseer op die massa -spektrometriese bepaling van Nier. Hierdie waarde is hersien na Ar(Sr) = 87.62(1) in 1969 en dit bly onveranderd sedertdien.
Wat het 'n massa van 1 amu?
'n Atoommassa-eenheid (gesimboliseer AMU of amu) word gedefinieer as presies 1/12 die massa van 'n atoom van koolstof-12. Die koolstof-12 (C-12) atoom het ses protone en ses neutrone in sy kern. In onakkurate terme is een AMU die gemiddelde van die proton rusmassa en die neutron rusmassa.
Aanbeveel:
Wat is die gemiddelde atoommassa van 'n atoom?

Die gemiddelde atoommassa van 'n element is die som van die massas van sy isotope, elk vermenigvuldig met sy natuurlike oorvloed (die desimale wat geassosieer word met persentasie atome van daardie element wat van 'n gegewe isotoop is). Gemiddelde atoommassa = f1M1 + f2M2 +
Hoe word die gemiddelde atoommassa op die periodieke tabel bepaal?

Die gemiddelde atoommassa vir 'n element word bereken deur die massas van die element se isotope op te som, elk vermenigvuldig met sy natuurlike oorvloed op Aarde. Wanneer enige massaberekeninge gedoen word wat elemente of verbindings insluit, gebruik altyd gemiddelde atoommassa, wat op die periodieke tabel gevind kan word
Hoe bereken jy die atoommassa van boor?
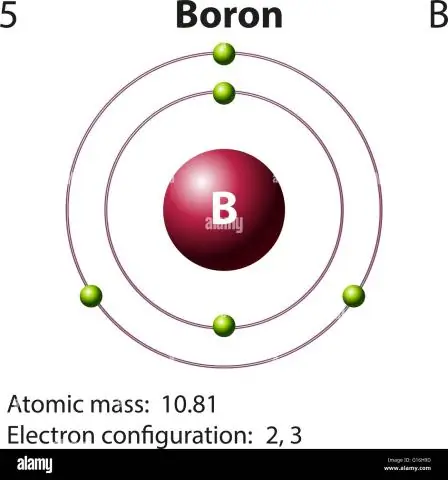
Vir boor sal hierdie vergelyking soos volg lyk: 5 protone + 5 neutrone = 10 atoommassa-eenhede (AMU) of, vir die meer algemeen voorkomende boor-isotoop (ongeveer 5 protone + 6 neutrone = 11 AMU)
Wat is die gemiddelde gemiddelde temperatuur van die aarde?

Die nasionale gemiddelde temperatuur was 2,91 °C (5,24 °F) bo die 1961–1990-gemiddelde, wat die vorige rekord wat in 2013 opgestel is, met 0,99 °C (1,78 °F) verpletter het
Hoe bereken jy atoommassa praktykprobleme?

VIDEO Hoe los jy dan atoommassaprobleme op? Om bereken die atoommassa van 'n enkele atoom van 'n element, tel die by massa van protone en neutrone. Voorbeeld: Vind die atoommassa van 'n isotoop van koolstof wat 7 neutrone het. Jy kan uit die periodieke tabel sien dat koolstof 'n atoom getal van 6, wat sy aantal protone is.
