
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
VIDEO
Hoe los jy dan atoommassaprobleme op?
Om bereken die atoommassa van 'n enkele atoom van 'n element, tel die by massa van protone en neutrone. Voorbeeld: Vind die atoommassa van 'n isotoop van koolstof wat 7 neutrone het. Jy kan uit die periodieke tabel sien dat koolstof 'n atoom getal van 6, wat sy aantal protone is.
Verder, wat is atoommassagetal? Die massa getal (simbool A, van die Duitse woord Atomgewicht [ atoom gewig]), ook genoem atoommassagetal of nukleon nommer , is die totaal nommer van protone en neutrone (saam bekend as nukleone) in 'n atoom kern. Die massa getal is verskillend vir elke verskillende isotoop van 'n chemiese element.
Om ook te weet is, wat is die formule van atoommassa?
Gemiddeld atoommassa = f1M1 + f2M2 +… + f M waar f die breuk is wat die natuurlike oorvloed van die isotoop voorstel en M die is massa nommer (gewig) van die isotoop. Die gemiddeld atoommassa van 'n element kan gevind word op die periodieke tabel, tipies onder die elementêre simbool.
Wat is die gemiddelde atoommassa in chemie?
Die gemiddelde atoommassa van 'n element is die som van die massas van sy isotope, elk vermenigvuldig met sy natuurlike oorvloed (die desimale wat geassosieer word met persentasie van atome van daardie element wat van 'n gegewe isotoop is).
Aanbeveel:
Wat is die gemiddelde atoommassa van 'n atoom?

Die gemiddelde atoommassa van 'n element is die som van die massas van sy isotope, elk vermenigvuldig met sy natuurlike oorvloed (die desimale wat geassosieer word met persentasie atome van daardie element wat van 'n gegewe isotoop is). Gemiddelde atoommassa = f1M1 + f2M2 +
Hoe bereken jy die gemiddelde atoommassa van strontium?

Dus, ons bereken dit deur die geweegde massa van elk van die isotope te neem en hulle bymekaar te tel. Dus, vir die eerste massa, vermenigvuldig ons 0,50% van 84 (amu - atoommassa-eenhede) = 0,042 amu, en voeg dit by 9,9% van 86 amu = 8,51 amu, ensovoorts
Hoe word die gemiddelde atoommassa op die periodieke tabel bepaal?

Die gemiddelde atoommassa vir 'n element word bereken deur die massas van die element se isotope op te som, elk vermenigvuldig met sy natuurlike oorvloed op Aarde. Wanneer enige massaberekeninge gedoen word wat elemente of verbindings insluit, gebruik altyd gemiddelde atoommassa, wat op die periodieke tabel gevind kan word
Hoe bereken jy die atoommassa van boor?
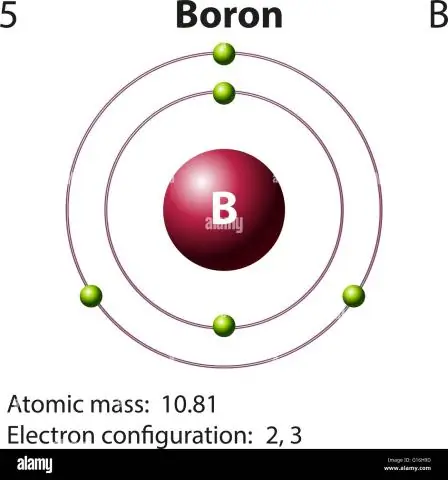
Vir boor sal hierdie vergelyking soos volg lyk: 5 protone + 5 neutrone = 10 atoommassa-eenhede (AMU) of, vir die meer algemeen voorkomende boor-isotoop (ongeveer 5 protone + 6 neutrone = 11 AMU)
Hoe word atoommassa-eenheid gemeet?

Atoommassa-eenheid. 'n Atoommassa-eenheid (afgekort: amu, u of Da) is 'n eenheid van meting wat gebruik word om die massa van atome te meet. Die atoommassa-eenheid is gelyk aan die ?1⁄12 van die massa van die koolstof-12. Die woord 'dalton' word mettertyd meer gebruik
