
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:12.
- Laas verander 2025-01-22 16:55.
Volg hierdie reëls om eenvoudige redoksvergelykings te balanseer:
- Skryf die oksidasie en vermindering half- reaksies vir die spesie wat is verminder of geoksideer .
- Vermenigvuldig die helfte- reaksies deur die toepaslike getal sodat hulle gelyke getalle elektrone het.
- Voeg die twee by vergelykings om die elektrone uit te kanselleer.
Verder, wat is oksidasie en reduksie met voorbeeld?
Vermindering is die proses om een of meer elektrone te verkry. In 'n oksidasie - vermindering , of redoks, reaksie, sal een atoom of verbinding elektrone van 'n ander atoom of verbinding steel. 'n Klassieke voorbeeld van 'n redoksreaksie roes. Suurstof kry verminder terwyl yster kry geoksideer.
Weet ook wat oksidasie veroorsaak? Die belangrikste spelers vir korrosie en oksidasie is suurstof en atmosferiese vog. Dit is 'n chemiese reaksie van die metaaloppervlak met die suurstof wat oorsake sommige van die metaal te korrodeer (of in ander terme oksideer) en vorm die oksidasie of beter bekend as metaal oksied op die oppervlak.
Met betrekking tot hierdie, hoe bepaal jy oksidasie en reduksie?
Tuis
- Ken oksidasiegetalle aan alle atome in die vergelyking toe.
- Vergelyk oksidasiegetalle vanaf die reaktantkant na die produkkant van die vergelyking.
- Die element wat geoksideer is, is die een waarvan die oksidasiegetal toegeneem het.
- Die element wat gereduseer is, is die een wie se oksidasiegetal afgeneem het.
Wat is 'n voorbeeld van 'n redoksreaksie in die daaglikse lewe?
Alledaagse redoksreaksies sluit in fotosintese, respirasie, verbranding en korrosie.
Aanbeveel:
Hoe skryf jy die formule vir 'n verbinding wat 'n poliatomiese ioon bevat?
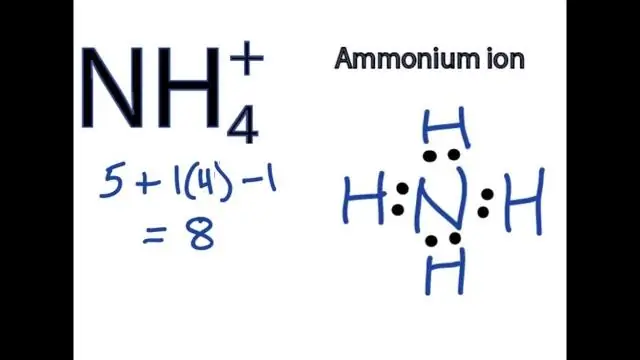
Om formules te skryf vir verbindings wat poliatomiese ione bevat, skryf die simbool vir die metaalioon gevolg deur die formule vir die poliatomiese ioon en balanseer die ladings. Om 'n verbinding te noem wat 'n poliatomiese ioon bevat, noem eers die katioon en dan die anioon
Hoe skryf jy PbO?

'n Beskrywing van hoe om die naam vir PbO, Lood(II)oksied te skryf. Eerstens bepaal ons of PbO 'n ioniese of molekulêre (kovalente) verbinding is deur die periodieke tabel te gebruik. Uit die periodieke tabel is Pb 'n metaal en O is 'n nie-metaal. Daarom is PbO 'n ioniese verbinding aangesien dit uit 'n metaal en nie-metaal bestaan
Hoe skryf jy 'n vergelyking in punthellingvorm gegewe twee punte?

Daar is verskeie vorme wat ons die vergelyking van 'n lyn kan skryf: die punt-helling-vorm, die helling-afsnitvorm, die standaardvorm, ens. Die vergelyking van 'n lyn met twee punte (x1, y1) en (x2, y2) ) waardeur die lyn gaan word gegee deur, ((y - y1)/(x - x1)) / ((y2 - y1)/(x2 - x1))
Hoe skryf jy atoomnotasie?

Die atoomgetal word geskryf as 'n onderskrif aan die linkerkant van die elementsimbool, die massagetal word as 'n boskrif aan die linkerkant van die elementsimbool geskryf, en die ioniese lading, indien enige, verskyn as 'n boskrif aan die regterkant van die element simbool. As die lading nul is, word niks in die ladingsposisie geskryf nie
Hoe skryf jy 'n voorbeeld van 'n tesisverklaring?

Wenk: Om 'n suksesvolle proefskrifverklaring te skryf: Vermy om 'n goeie proefskrifverklaring in die middel van 'n paragraaf of laat in die vraestel te begrawe. Wees so duidelik en so spesifiek as moontlik; vermy vae woorde. Dui die punt van jou vraestel aan, maar vermy sinstrukture soos: "Die punt van my vraestel is …"
