
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Reduseermiddels Kan wees gerangskik deur krag te verhoog deur posisie hulle vermindering potensiaal. Die reduseermiddel is sterker as dit 'n meer negatiewe het vermindering potensiaal en swakker wanneer dit 'n meer positiewe vermindering potensiaal.
Net so kan jy vra, hoe identifiseer jy oksideer- en reduseermiddels?
A reduseermiddel is 'n stof wat veroorsaak dat 'n ander stof verminder . So aan identifiseer 'n oksideermiddel , kyk bloot na die oksidasiegetal van 'n atoom voor en na die reaksie. As die oksidasiegetal groter is in die produk, het dit elektrone verloor en die stof is geoksideer.
Verder, watter elemente is goeie reduseermiddels? Goeie reduseermiddels sluit die aktiewe metale in, soos natrium , magnesium , aluminium en sink, wat relatief klein ionisasie-energieë en lae elektro-negatiwiteite het. Metaalhidriede, soos NaH, CaH2, en LiAlH4, wat formeel die H- ioon, is ook goeie reduseermiddels.
Die vraag is ook, hoe vind jy die swakste reduseermiddel?
Verduideliking: Hier is 'n tipiese tabel van standaard vermindering potensiaal. Die spesies links bo het die grootste "potensiaal" om te verminder, so hulle is die sterkste oksiderende agente . Die sterkste oksiderende agent in die lys is F2, gevolg deur H2O2, en so aan tot by die swakste oksideer agent , Li+.
Is HCl 'n sterk reduseermiddel?
HCl (Cl^-) kan geoksideer word na chloorgas (Diacon-reaksie) deur gebruik te maak van a sterker oksideer agent as HCl (TiO2). HCl (H^+) kan tot waterstofgas gereduseer word deur 'n swakker oksidasie agent as HCl ( sterker reduseermiddel ) soos Zn. Daar is geen uiteindelike oksidasie nie agent of reduseermiddel.
Aanbeveel:
Hoe is grondverskuiwings en moddervloei soortgelyk Hoe verskil hulle?

Swaartekrag veroorsaak massabewegings. Grondverskuiwings, moddervloei, kruipe en hellings is agente van erosie. Grondverskuiwings bevat slegs rots en grond, terwyl moddervloei rots, grond en 'n hoë persentasie water bevat
Hoe bereken jy hoe ver 'n voorwerp sal beweeg?

Horisontale afstand afgelê kan uitgedruk word as x = Vx * t, waar t die tyd is. Vertikale afstand vanaf die grond word beskryf deur die formule y = h + Vy * t – g * t² / 2, waar g die swaartekragversnelling is
Hoe het organiese verbindings hul naam gekry. Hoe hou die woord verband met sy betekenis?
Hoe hou die woord verband met sy betekenis? Organiese verbindings kry sy naam van die aantal koolstofbindings. Die woord hou verband met die betekenis omdat dit te doen het met bindings in koolstofatome in organiese verbindings
Hoe rangskik jy chemikalieë in 'n laboratorium?
Laboratoriumrakke moet 'n verhoogde lip langs die buitenste rand hê om te verhoed dat houers val. Moet nooit toelaat dat die houer van die rand van die rak hang nie! Vloeibare of bytende chemikalieë moet nooit op rakke bo ooghoogte gestoor word nie. Glashouers moet nie aan mekaar op die rakke raak nie
Hoe word hoë eilande geskep?
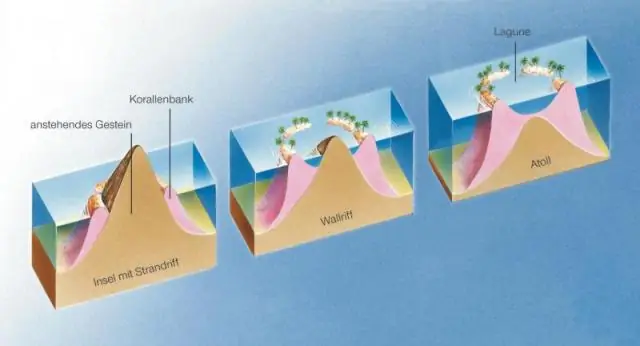
Eilande kan gevorm word deur 'n vulkaniese uitbarsting op die seebodem, ophoping van sedimente in 'n area binne die waterliggaam, of rifbou. Eilande wat deur vulkaniese uitbarstings gevorm word, word na verwys as hoë eilande of vulkaniese eilande
