- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
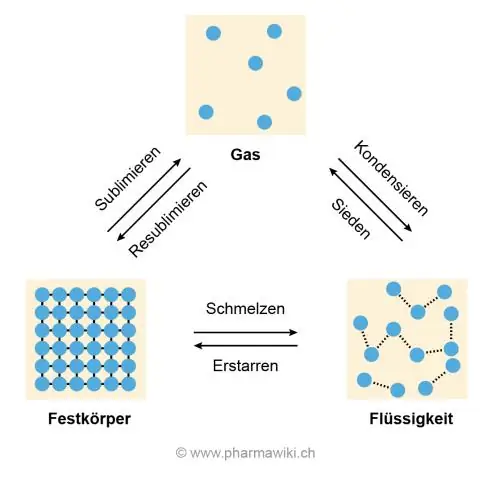
Die rede vir die hoë smelting en kook temperature is die waterstofbinding tussen water molekules wat veroorsaak dat hulle aan mekaar vashou en weerstaan om uitmekaar getrek te word, wat gebeur wanneer ys smelt en water kook om 'n gas te word.
Op hierdie manier, hoekom het water 'n lae smeltpunt?
Water molekules is aan mekaar geheg deur hidogeenbindings wat effens sterker is as van dar Waals-krag; daarom is dit vloeibaar by kamertemperatuur. Tog het dit baie geverg laag energie om die H-bindingsenergie uit te skakel in vergelyking met die ioniese bindings. Daarom is sy smeltpunt is relatief laer.
Gevolglik is die vraag, hoekom is die kookpunt van water hoër as sy smeltpunt? Die chemiese eienskappe van water (hoofsaaklik is dit hoog polariteit en waterstofbinding) verseker dat dit baie verg as energie verander sy staat. Die kookpunt is hoër want gasse is altyd warmer as 'n vaste stof van dieselfde stof.
Met betrekking tot hierdie, het water 'n hoë smeltpunt?
0 °C
Wat is die sterkste intermolekulêre krag in water?
Die sterkste intermolekulêre krag in water is 'n spesiale dipoolbinding wat die waterstofbinding . Baie molekules is polêr en kan bipool-bipoolbindings vorm sonder om te vorm waterstofbindings of selfs het waterstof in hul molekule.
Aanbeveel:
Hoe verskil water onder sy smeltpunt en bokant dit?

Hoe verskil water onder sy smeltpunt en bokant dit? Daaronder bly dit naby mekaar en hulle bons van mekaar af. Bo kom die molekules selfs nader as onder. Die kook-/kondensasiepunt van water is 373K
Hoekom het alkalimetale 'n lae smeltpunt?

Alkalimetale het laer smelt- en kookpunte. Hierdie elektron kan verder van die kern af wegdryf as in die meeste atome van ander elemente. Die toenemende atoomradius beteken swakker kragte tussen die atome en dus 'n laer smelt- en kookpunt
Het water 'n lae smeltpunt?

Water het eintlik nie 'n lae smeltpunt in vergelyking met ander kovalente verbindings nie. Die meeste van die lae molêre massa kovalente verbindings is gasvormig by kamertemperatuur terwyl water vloeibaar is. Kovalente bindings is sterk genoeg, maar hulle is beperk tot individuele molekules nie tot die hele stuk van die verbinding nie
Hoekom het aluminium 'n hoër smeltpunt as natrium?

Oor die tydperk neem die valensie toe (van valensie 1 in natrium na valensie 3 in aluminium) sodat die metaalatome meer elektrone kan delokaliseer om meer positief gelaaide katione en 'n groter see van gedelokaliseerde elektrone te vorm. Daarom word metaalbinding sterker en smeltpunt styg van natrium na aluminium
Waarom het water 'n hoë kookpunt en smeltpunt?

Die rede vir die hoë smelt- en kooktemperature is die waterstofbinding tussen watermolekules wat veroorsaak dat hulle aan mekaar vassit en nie uitmekaar getrek word nie, wat gebeur wanneer ys smelt en water kook om 'n gas te word
