
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-11-26 05:34.
- Laas verander 2025-01-22 16:55.
daar is 7 elektrone in Br valensieskil waaruit 5 elektrone binding met F gemaak het, terwyl die oorblywende twee 'n eensaam paar. en dus slegs 1 eensaam paar bestaan in BrF5.
Ook gevra, hoeveel valenselektrone is in BrF5?
42
Verder, hoeveel domeine het o2? drie
Net so, vra mense, wat is die elektroniese geometrie van broompentafluoried BrF5?
BrF5 - BroomPentafluoried : Die molekulêre meetkunde van BrF5 vierkantige piramidaal met asimmetriese ladingverspreiding op die sentrale atoom.
Hoe tel jy elektrondomeine?
Reël die elektrondomeine rondom die sentrale atoom om afstoting te minimaliseer. Tel die totaal nommer van elektrondomeine . Gebruik die hoekrangskikking van die chemiese bindings tussen die atome om die molekulêre geometrie te bepaal. Hou in gedagte, veelvuldige bindings (d.w.s. dubbelbindings, drievoudige bindings) tel soos een elektrondomein.
Aanbeveel:
Hoeveel EcoRI-plekke is daar in lambda-DNS?
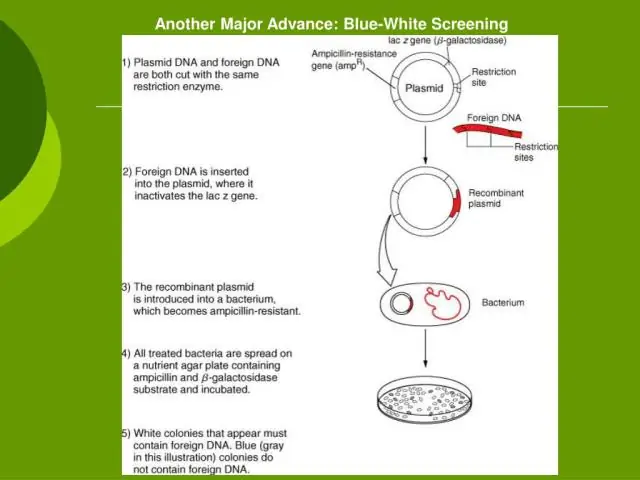
Die Lambda-DNS wat in hierdie eksperiment gebruik word, word as 'n lineêre molekule van die E. coli-bakteriofaag lambda geïsoleer. Dit bevat ongeveer 49 000 basispare en het 5 herkenningsplekke vir Eco RI, en 7 vir Hind III
Hoeveel liter is in 'n sekonde?

1 kubieke meter/sekonde is gelyk aan 1000 liter per sekonde
Is BrF5 oktaëdraal?

BrF5 of broompentafluoried is 'n polarmolekule. Die molekulêre geometrie van BrF5 is vierkantig piramidaal met 'n asimmetriese ladingverspreiding. Die molekule het 'n sentrale broomatoom wat omring word deur vyf fluoriede en alleen paar elektrone. Die elektrongeometrie is oktaëdraal, en die hibridisasie is sp3d2
Hoeveel alleenpare word in die struktuur van asetoon aangetref?

Die enoliese vorm van asetoon bevat: (a) 9 σ verbande,1π bindings en 2 alleenpare (b) 8 σ-bindings,2 π-bindings en 2 alleenpare (c) 10 σ-bindings,1 π -bindings en 1 alleenpaar (d) 9 σ-bindings, 2 π-bindings en 1 alleenpare
Hoeveel alleenpare is in kafeïen?

Die elemente van belang in kafeïen vir alleenpare is stikstof en suurstof; ongelaaide koolstofstowwe sal geen alleenpare hê nie. Suurstof met twee bindings en 'n volle oktet sal twee alleenpare hê, terwyl stikstof met drie bindings en 'n volle oktet een alleenpaar sal hê. Daarom is daar 8 alleenpare in kafeïen
