
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Kom ons neem 'n voorbeeld van 'n buffer bestaan uit die swak basis ammoniak , NH3 en sy gekonjugeerde suur, NH4+. Wanneer HCl (sterk suur) word hierby gevoeg buffer stelsel, word die ekstra H+-ione wat by die stelsel gevoeg word, verbruik deur die NH3 aan vorm NH4+. Die verdere byvoeging van 'n suur of basis tot die buffer sal sy pH vinnig verander.
Is nh3 en NH4Cl eweneens 'n bufferoplossing?
Antwoord en verduideliking: Ammoniak en ammoniumchloried buffer is 'n mengsel van swak suur en sy sout. Dit is 'n basiese buffer omdat basisdissosiasiekonstante vir ammoniak groter is as suurkonstante vir ammoniumione.
Net so, watter tipe reaksie is HCl en nh3? Dus NH3 by die ontvangs van die H+ van HCl (H+ en Cl-) vorm NH4+ (ammoniumioon) wat by binding met Cl- ioon (vanaf HCl ) gee NH4Cl (ammoniumchloried). Die reaksie word voorgestel as NH3 + HCl = NH4Cl.
Die vraag is ook, watter reaksie vind plaas wanneer HCl by ammoniakbuffer gevoeg word?
Die soutwater suur sou heftig met die ammoniak reageer om ammoniumchloried te vorm (wat 'n baie effens suur sout is, oor die algemeen onskadelik), wat die basaliteit van die oplossing neutraliseer, en sterk vorming van waterstofgasborrels sal waargeneem word, as bruis van die oplossing.
Hoe maak jy 'n ammoniakbufferoplossing?
Ammoniak - Ammoniumchloried Buffer : Los 67,5 g ammoniumchloried op in ongeveer 200 ml water, voeg 570 ml sterk by ammoniak oplossing en verdun met water tot 1000 ml. Ammoniakbuffer pH 9,5: Los 33,5 g ammoniumchloried op in ISO ml water en 42 ml 10M ammoniak en verdun met water tot 250 ml.
Aanbeveel:
Watter oplossing is 'n buffer?

'n Bufferoplossing is een wat veranderinge in pH weerstaan wanneer klein hoeveelhede van 'n suur of 'n alkali daarby gevoeg word. Suur bufferoplossings. 'n Suurbufferoplossing is eenvoudig een wat 'n pH minder as 7 het. Suurbufferoplossings word gewoonlik gemaak van 'n swak suur en een van sy soute - dikwels 'n natriumsout
Waarom werk 'n buffer die beste by 'n pH naby sy pKa?
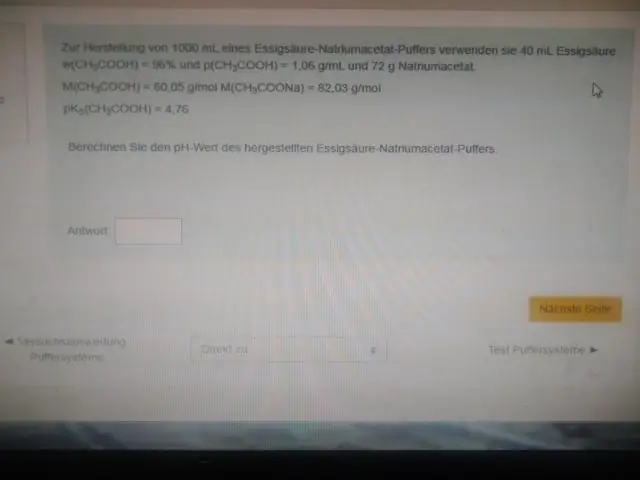
Met ander woorde, die pH van die ekwimolêre oplossing van suur (bv. wanneer die verhouding van die konsentrasie van suur en gekonjugeerde basis 1:1 is) is gelyk aan die pKa. Hierdie gebied is die doeltreffendste om groot veranderinge in pH te weerstaan wanneer óf suur óf basis bygevoeg word. 'n Titrasiekurwe demonstreer bufferkapasiteit visueel
Kan 'n sterk suur en swak basis 'n buffer maak?

Soos jy gesien het in die berekening van die pH van oplossings, is slegs 'n klein hoeveelheid van 'n sterk suur nodig om die pH drasties te verander. 'n Buffer is bloot 'n mengsel van 'n swak suur en sy gekonjugeerde basis of 'n swak basis en sy gekonjugeerde suur. Buffers werk deur met enige bygevoegde suur of basis te reageer om die pH te beheer
Wat is die funksie van PCR buffer?

Oorspronklik beantwoord: Wat is die rol van 'n buffer in 'n PCR? Tipies is 'n buffer 'n oplossing wat pH-veranderinge kan weerstaan deur klein hoeveelhede bygevoegde suur of basiese verbindings chemies te neutraliseer en sodoende die algehele pH van 'n medium te handhaaf. Hoekom is dit nodig vir PCR? DNA is pH-sensitief
Wat is 'n buffer Khan Academy?

Oor Transkripsie. 'n Bufferoplossing bevat 'n mengsel van 'n swak suur en sy gekonjugeerde basis (of 'n swak basis en sy gekonjugeerde suur). Die ewewig tussen die swak suur en sy gekonjugeerde basis laat die oplossing toe om veranderinge aan pH te weerstaan wanneer klein hoeveelhede sterk suur of basis bygevoeg word
