
- Outeur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
Hierdie sakrekenaar bereken die effek van temperatuur op reaksietempo's deur die Arrhenius vergelyking. k=A*uitg(-Ea/R*T) waar k die snelheidskoëffisiënt is, A is a konstant , Ea is die aktiveringsenergie, R is die universele gas konstant , en T is die temperatuur (in kelvin). R het die waarde van 8,314 x 10-3 kJ mol-1K-1.
Met betrekking tot hierdie, wat is die waarde van die Arrhenius konstante?
Die waarde van die gas konstant , R, is 8,31 J K-1 mol-1.
Gevolglik is die vraag, hoe vind jy die Arrhenius-konstante? Die Arrhenius-vergelyking is k = Ae^(-Ea/RT), waar A die frekwensie of pre-eksponensiële faktor is en e^(-Ea/RT) die fraksie van botsings is wat genoeg energie het om te reageer (dws energie het groter as of gelyk aan die aktiveringsenergie Ea) by temperatuur T.
Weet ook, WAT BETEKEN A in Arrhenius-vergelyking?
Let wel: Die Arrhenius-vergelyking word soms uitgedruk as k = Ae-E/RT waar k is die tempo van chemiese reaksie, A is 'n konstante afhangende van die betrokke chemikalieë, E is die aktiveringsenergie, R is die universele gaskonstante, en T is die temperatuur.
Hoekom is die Arrhenius-vergelyking belangrik?
Arrhenius-vergelyking is so belangrik omdat dit ons toelaat om rekening te hou met daardie faktore wat die tempo van 'n reaksie beïnvloed wat ons nie op die tempowette kan sien nie, naamlik: temperatuur, teenwoordigheid van 'n katalisator, energieversperring, frekwensie en oriëntasie van botsings …
Aanbeveel:
Wat is die naam van die chemiese stof waar die energie tydens die eerste fase van fotosintese gestoor word?
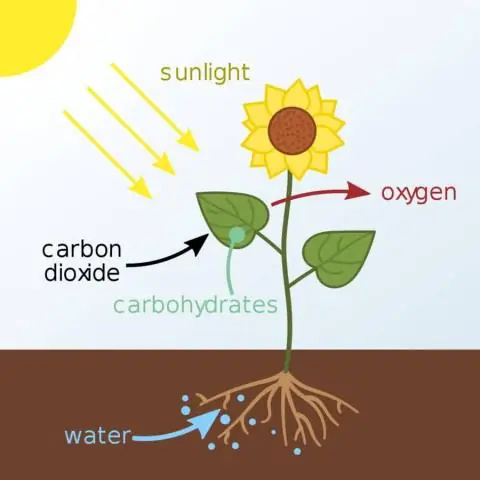
Die ligafhanklike reaksies gebruik ligenergie om twee molekules te maak wat nodig is vir die volgende stadium van fotosintese: die energiebergingsmolekule ATP en die gereduseerde elektrondraer NADPH. By plante vind die ligreaksies plaas in die tilakoïedmembrane van organelle wat chloroplaste genoem word
Wat is die verskil tussen die Arrhenius-definisie en die brønsted Lowry-definisie van sure en basisse?

Die verskil tussen die drie teorieë is dat die Arrhenius-teorie stel dat die sure altyd H+ bevat en dat die basisse altyd OH- bevat. Terwyl die Bronsted-Lowry-model beweer dat sure protonskenkers en pron-aannemers is, hoef basisse nie OH te bevat nie, dus skenk sure 'n proton aan water wat H3O+ vorm
Wat is die Arrhenius-konsep van sure en basisse?

Die Arrhenius suur-basis konsep klassifiseer 'n stof as 'n suur as dit waterstofione H(+) of hidroniumione in water produseer. 'n Stof word as 'n basis geklassifiseer as dit hidroksiedione OH(-) in water produseer. Ander maniere om stowwe as sure of basisse te klassifiseer is die Bronsted-Lowry-konsep en die Lewis-konsep
Wat is die naam van die ensiem wat die sintese van die mRNA-streng kataliseer?
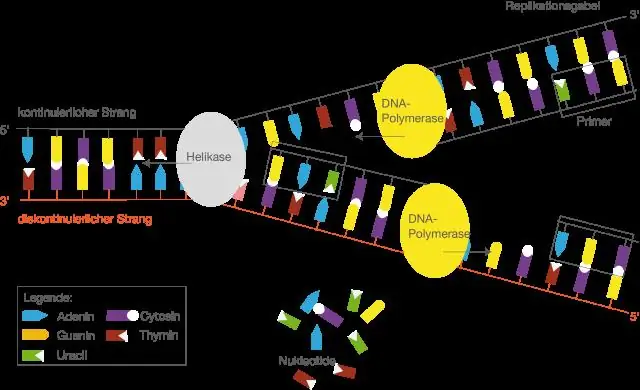
MRNA is "boodskapper" RNA. mRNA word in die kern gesintetiseer deur die nukleotiedvolgorde van DNA as 'n sjabloon te gebruik. Hierdie proses vereis nukleotiedtrifosfate as substrate en word deur die ensiem RNA-polimerase II gekataliseer. Die proses om mRNA van DNA te maak, word transkripsie genoem, en dit vind in die kern plaas
Hoe gebruik jy die Arrhenius-vergelyking?

As jy hierdie vergelyking moet gebruik, vind net die 'ln'-knoppie op jou sakrekenaar. Jy kan die Arrhenius-vergelyking gebruik om die effek van 'n temperatuurverandering op die tempokonstante te wys - en dus op die tempo van die reaksie. As die tempokonstante byvoorbeeld verdubbel, sal die tempo van die reaksie ook so verdubbel
