
- Outeur Miles Stephen [email protected].
- Public 2023-12-15 23:33.
- Laas verander 2025-01-22 16:55.
In die voorbeeld, een molekule van HCl produseer een waterstofioon. Vermenigvuldig die suurkonsentrasie met die aantal waterstofione wat geproduseer word om die konsentrasie [H+] te bereken. Byvoorbeeld, as die konsentrasie van HCL in die oplossing is 0,02 molêr, dan is die konsentrasie waterstofione 0,02 x 1 = 0,02 molêr.
Wat is dan die H+ van HCl?
Omdat ons 'n sterk suur is, kan ons dit aanneem HCl dissosieer (ioniseer) heeltemal in water. Daarbenewens, aangesien een molekule van HCl lewer een op [ H+ ], die ekwivalente massa is gelyk aan die molekulêre massa. Daarom 'n een molêre oplossing van HCl (een molekulêre massa per liter), lewer 'n een molêre oplossing van [ H+ ].
Mens kan ook vra, hoe bereken jy H+ vanaf pH? Die pH van 'n oplossing is gelyk aan die basis 10 logaritme van die H+ konsentrasie, vermenigvuldig met -1. As jy weet die pH van 'n wateroplossing, kan jy dit gebruik formule in omgekeerde om die antilogaritme te vind en bereken die H+ konsentrasie in daardie oplossing. Wetenskaplikes gebruik pH om te meet hoe suur of basiese water is.
Hierin, is H+ dieselfde as HCl?
Soutsuur ( HCl ) verdeel in waterstofione (H+) en chloriedione (Cl-). Ekstra H+ beteken suuroplossing (nie meer gelyke dele nie).
Is HCl 'n sterk suur?
A sterk suur is 'n suur wat heeltemal geïoniseer word in 'n waterige oplossing. Waterstofchloried ( HCl ) ioniseer heeltemal in waterstofione en chloriedione in water. 'n Swak suur is 'n suur wat net effens in 'n waterige oplossing ioniseer. Omdat HCl is 'n sterk suur , sy gekonjugeerde basis (Cl−) is uiters swak.
Aanbeveel:
Hoe vind jy ortogonale trajekte van die familie van krommes?
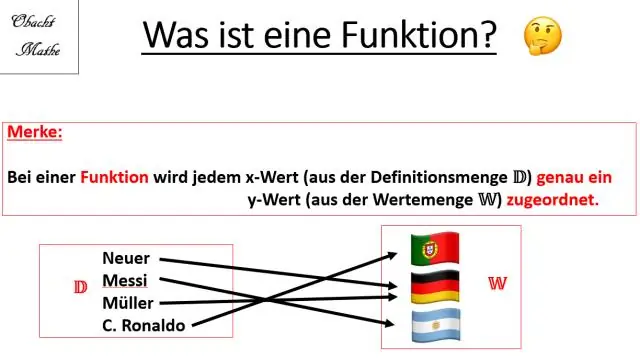
Die algoritme sluit die volgende stappe in: Konstrueer die differensiaalvergelyking G(x,y,y′)=0 vir die gegewe familie van krommes g(x,y)=C. Vervang y′ met (−1y′) in hierdie differensiaalvergelyking. Los die nuwe differensiaalvergelyking op om die algebraïese vergelyking van die familie van ortogonale trajekte te bepaal f(x,y)=C
Hoe vind jy die lengte van 'n sektor van 'n sirkel?

'n Sentrale hoek wat deur 'n hoofboog onderspan word, het 'n maat groter as 180°. Die booglengteformule word gebruik om die lengte van 'n boog van 'n sirkel te vind; l=rθ l = r θ, waar θ is in radiale. Sektorarea word gevind A=12θr2 A = 1 2 θ r 2, waar θ is in radiale
Hoe vind jy denkbeeldige wortels met behulp van Descartes-reël van tekens?

Descartes se reël van tekens sê die aantal positiewe wortels is gelyk aan veranderinge in teken van f(x), of is minder as dit met 'n ewe getal (so jy hou aan om 2 af te trek totdat jy óf 1 óf 0 kry). Daarom kan die vorige f(x) 2 of 0 positiewe wortels hê. Negatiewe werklike wortels
Hoe vind jy die waarde van cosinus van 'n driehoek?

In enige reghoekige driehoek is die cosinus van 'n hoek die lengte van die aangrensende sy (A) gedeel deur die lengte van die skuinssy (H). In 'n formule word dit eenvoudig as 'cos' geskryf. Word dikwels onthou as 'CAH' - wat beteken Cosinus is aangrensend bo hipotenusa
Hoe vind jy die vergelyking van die raaklyn van 'n afgeleide?

1) Vind die eerste afgeleide van f(x). 2) Prop xwaarde van die aangeduide punt in f '(x) om die helling by x te vind. 3) Prop x-waarde in f(x) om die y-koördinaat van die tangenspunt te vind. 4) Kombineer die helling van stap 2 en punt van stap 3 deur die punt-helling formule te gebruik om die vergelyking vir die raaklyn te vind
